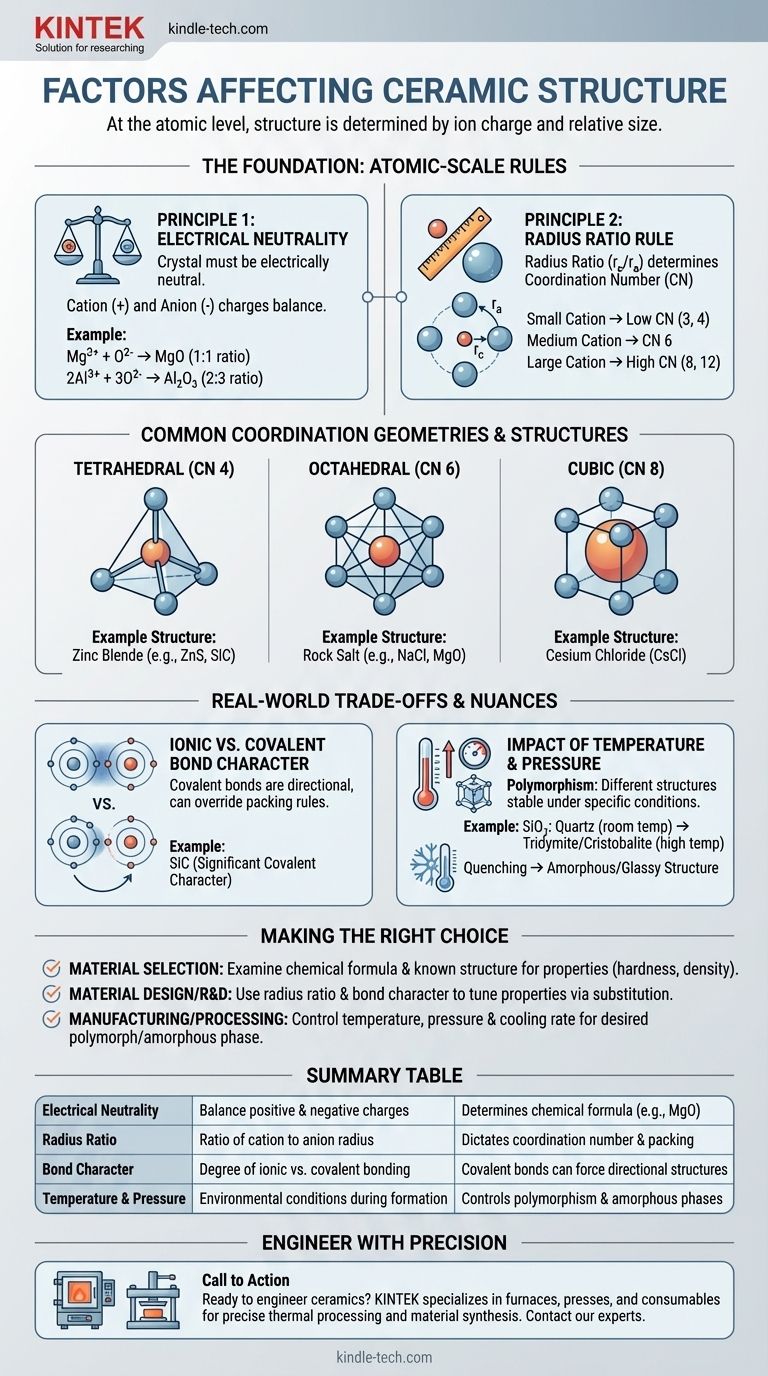
原子レベルでは、セラミックスの結晶構造は、構成イオンの電気電荷とそれらのイオンの相対的なサイズの2つの主要な要因によって決定されます。安定した低エネルギー構造を形成するためには、原子の配置が電荷の中立性を満たしつつ、可能な限り幾何学的に効率的な方法で充填される必要があります。
任意のセラミックス結晶構造を形成する上での根本的な課題は、競合する力のバランスを取ることです。陽イオンと陰イオンは引き合い、密度の高い構造を作りますが、それらの相対的なサイズが、全体的な電気的中性を維持しながら物理的に達成できる特定の幾何学的配置、すなわち配位数(Coordination Number)を決定します。
基礎:原子スケールのルール
酸化マグネシウム(MgO)のようなセラミックスが1つの構造を形成し、炭化ケイ素(SiC)が別の構造を形成する理由を理解するには、原子が安定した結晶格子に配列する方法を支配する2つの譲れないルールから始める必要があります。
原則1:電気的中性の法則
最も基本的な要件は、結晶が電気的に中性でなければならないということです。陽イオンからの全正電荷の合計は、陰イオンからの全負電荷の合計によって正確にバランスされなければなりません。
この原則は化学式そのものを決定します。例えば、マグネシウムイオンが+2の電荷(Mg²⁺)を持ち、酸素イオンが-2の電荷(O²⁻)を持つため、これらは1:1の比率で結合してMgOを形成します。アルミニウムイオン(Al³⁺)と酸素イオン(O²⁻)は、中立性を達成するために2:3の比率で結合してAl₂O₃を形成する必要があります。
原則2:半径比の法則
化学式が決定されたら、幾何学が重要になります。半径比—陽イオンの半径(r_c)を陰イオンの半径(r_a)で割った値—は、配位数(CN)を決定する重要な要因です。
配位数は、中心の陽イオンの周りに充填できる陰イオンの数にすぎません。小さなテニスボール(陽イオン)の周りにバスケットボール(陰イオン)を詰め込もうとすることを想像してください。それらが互いに触れ始める前に、いくつかを詰め込むことができるだけです。テニスボールをより大きなサッカーボールに置き換えると、その周りにさらに多くのバスケットボールを詰め込むことができます。相対的なサイズが充填幾何学を決定します。
原子充填から結晶構造へ
これら2つの原則が連携して、セラミックスの結晶構造を定義する反復的な三次元パターンを生み出します。半径比は配位数を予測し、電荷の中立性の必要性が、これらの配位ユニットが空間内でどのように結合するかを決定します。
一般的な配位幾何学
特定の半径比の範囲は、好ましい配位数とその対応する形状を強く示唆します。
- 小さな陽イオンは、3(三角形)や4(四面体)のような低いCNをもたらします。
- 中程度の大きさの陽イオンは、6(八面体)のCNを可能にします。
- 陰イオンとほぼ同じ大きさの大きな陽イオンは、8(立方体)またはさらに12のCNを達成できます。
一般的なセラミックス構造の例
これらのルールから、一般的な鉱物にちなんで名付けられたよく知られた結晶構造が生まれます。単純なAX型セラミックス(陽イオン1つ、陰イオン1つ)の場合:
- 岩塩構造(例:NaCl、MgO):陽イオンと陰イオンの両方で配位数6を特徴とします。陽イオンと陰イオンのサイズ差が中程度の場合に非常に安定した一般的な構造です。
- 塩化セシウム構造(CsCl):陽イオンが陰イオンとほぼ同じ大きさである場合に発生し、より密に充填された配位数8を可能にします。
- 閃亜鉛鉱構造(例:ZnS、SiC):陽イオンが陰イオンよりもかなり小さい場合に形成され、配位数4(四面体)になります。この構造は、強い共有結合を持つ材料の特徴でもあります。
AₘXₚ(例:Al₂O₃、CaF₂)のようなより複雑な化学式の場合も、同じ原則が適用されます。構造は、すべてのイオンが好ましい配位を達成し、全体の電荷が中立に保たれるように、単により複雑な配置になります。
トレードオフと限界の理解
これらの原則は強力な枠組みを提供しますが、それは単純化されたモデルです。現実世界の要因は、最終的な構造を変更する重要なニュアンスをもたらします。
イオン結合と共有結合の性質
半径比の法則は、純粋なイオン結合に対して最もよく機能します。しかし、炭化ケイ素(SiC)や窒化ケイ素(Si₃N₄)のような多くのセラミックスは、かなりの共有結合性を持っています。
共有結合は非常に方向性があります。原子は特定の角度(例:四面体では109.5°)で結合することを好みます。これらの材料では、方向性のある共有結合を満たす必要性が、半径比の単純な充填ルールを上回り、四面体配位のような特定の構造を強制します。
温度と圧力の影響
単一の化学化合物は、しばしば複数の異なる結晶構造を取り得ます。これは多形(polymorphism)として知られる現象です。これらの構造、すなわち多形(polymorphs)のそれぞれは、特定の温度と圧力の範囲で安定しています。
例えば、シリカ(SiO₂)は室温では石英として存在しますが、高温ではトリディマイトやクリストバライトのような他の多形に変化します。これらの転移は、その条件下でより安定な新しい構造へと原子が再配列することを含みます。
さらに、溶融したセラミックスが非常に急速に冷却された(焼入れ、quenching)場合、原子は秩序だった結晶格子に配列するのに十分な時間をかけられないことがあります。その結果、無秩序な非晶質(amorphous)、またはガラス状の構造になります。
用途に応じた適切な選択
これらの要因を理解することで、セラミックスの処理と組成を、その最終的な構造、そして究極的にはその性能に結びつけることができます。
- 材料選択が主な焦点の場合: 化学式と既知の結晶構造の調査から始めます。アルミナ(Al₂O₃)のような高配位の密な構造は、高い硬度と密度を示唆しますが、低配位構造は異なる特性を持つ可能性があります。
- 材料設計や研究開発が主な焦点の場合: 半径比と結合の性質をツールとして使用します。異なるサイズや電気陰性度の原子を置換することで、結晶構造を意図的にシフトさせ、特性を調整することができます。
- 製造と処理が主な焦点の場合: 主要な変数は温度、圧力、冷却速度です。これらを使用して、どの多形が形成されるかを制御するか、結晶質と非晶質の最終製品のどちらにするかを決定します。
電荷、サイズ、処理条件の相互作用を把握することで、単にセラミックスを使用する段階から、特定の目的のために意図的に設計する段階へと進むことができます。
要約表:
| 要因 | 説明 | 構造への主な影響 |
|---|---|---|
| 電気的中性 | 結晶内の全正電荷と全負電荷がバランスしなければならない。 | 化学式を決定する(例:MgO、Al₂O₃)。 |
| 半径比 | 陽イオン半径と陰イオン半径の比率(r_c/r_a)。 | 配位数と充填幾何学(例:四面体、八面体)を決定する。 |
| 結合の性質 | イオン結合と共有結合の度合い。 | 共有結合は、単純な充填ルールを上回る方向性のある構造を強制する場合がある。 |
| 温度と圧力 | 形成および処理中の環境条件。 | 多形(異なる結晶形)の制御、および非晶質/ガラス相の形成を制御する。 |
精密なセラミックス設計の準備はできましたか? 材料の構造と性能を定義する要因を制御するには、適切な実験装置が不可欠です。KINTEKは、正確な熱処理と材料合成のために研究室が必要とする炉、プレス、消耗品を専門としています。お客様の特定の材料目標を達成するために、当社のソリューションがどのようにお役立てできるかについて、今すぐ専門家にご相談ください。
ビジュアルガイド
関連製品
- 炭化ケイ素(SiC)セラミックシート 耐摩耗性エンジニアリング 高性能ファインセラミックス
- エンジニアリング先進ファインセラミックス用精密加工窒化ケイ素(SiN)セラミックシート
- 実験室用試験ふるいおよびふるい機
- エンジニアリング先進ファインセラミックス用精密加工ジルコニアセラミックボール
- 断熱材用エンジニアリング先進ファインセラミックス酸化アルミニウムAl2O3ヒートシンク



















