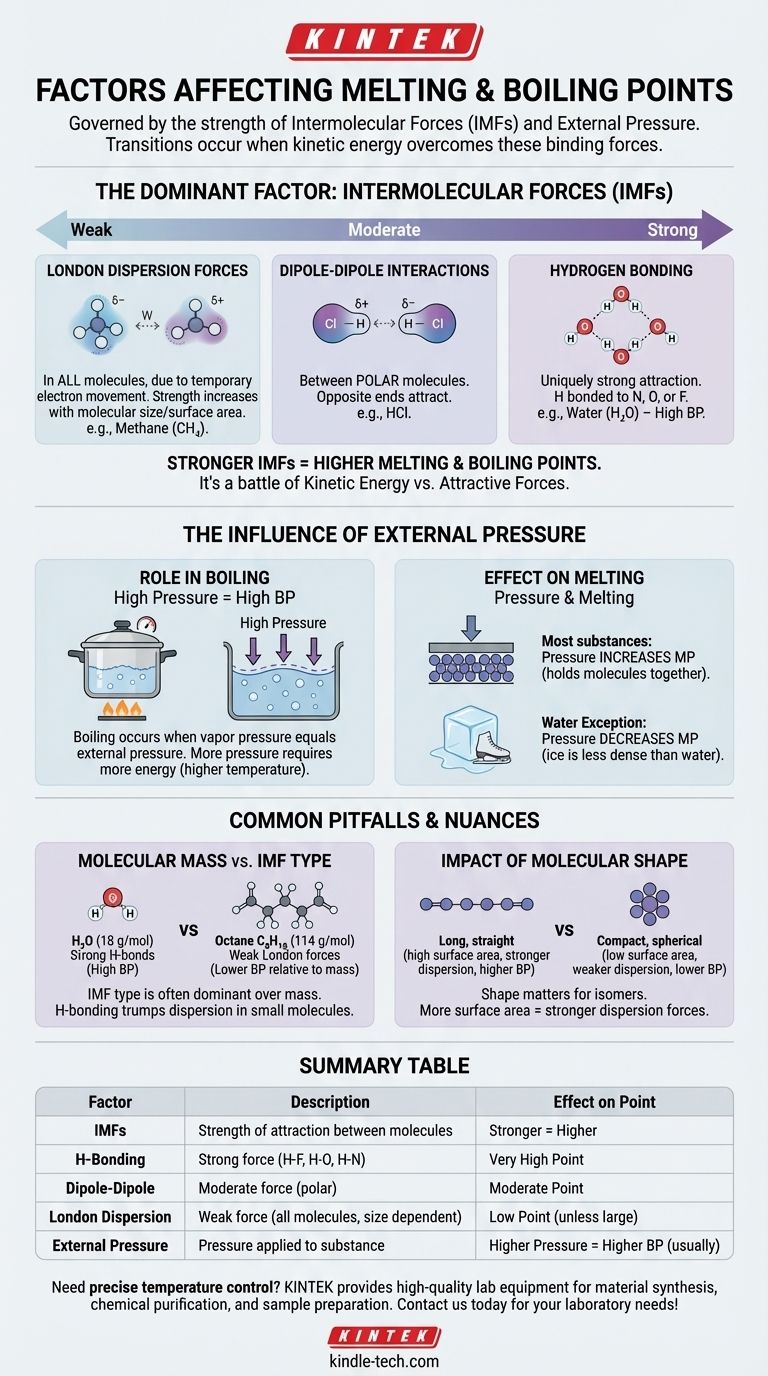
根本的に、物質の融点と沸点は、分子同士を結びつけている分子間力(IMF)の強さと、それに加えられる外部圧力という2つの主要な要因によって支配されています。本質的に、これらの転移は、分子がそれらを結合させている力と、それらを閉じ込めている圧力を克服するのに十分なエネルギーを得たときに起こります。
重要な点は、融解と沸騰は単なる温度の問題ではなく、分子の運動エネルギーと、分子を隣接するものに引きつけている引力との物理的な戦いであるということです。その引力が強いほど、それらを分離するために必要なエネルギーは大きくなります。
主要因:分子間力(IMF)
物質の融点と沸点を決定する最も重要な単一の要因は、個々の分子間の引力の強さです。これらは、分子内の強力な共有結合ではなく、分子同士をくっつける弱い力です。
分子間力とは?
IMFを磁石の分子レベルでの同等物と考えてください。一部の分子は強力な電磁石のようであり、他の分子は弱い冷蔵庫の磁石のようです。この「粘着性」を克服するには、熱の形でエネルギーが必要です。
力の階層
分子間力は強さが異なり、明確な階層を作り出します。この階層を理解することが、どの物質がより高いまたは低い沸点を持つかを予測する鍵となります。
水素結合(最も強い) これは、水素が窒素(N)、酸素(O)、フッ素(F)のような高い電気陰性度を持つ原子と結合しているときに起こる、特異的に強い種類の引力です。水(H₂O)はその古典的な例であり、その強力な水素結合が、その小さなサイズにもかかわらず驚くほど高い沸点を持つ理由です。
双極子-双極子相互作用(中程度) これらの力は、一方の端に永続的な部分的な正電荷を、もう一方の端に部分的な負電荷を持つ極性分子の間に存在します。これらの反対の端がお互いに引き合い、物質を中程度にしっかりと保持します。
ロンドン分散力(最も弱い) これらはすべての分子に存在し、電子の一時的でランダムな動きによって引き起こされ、一時的な双極子を形成します。個々には弱いですが、分子のサイズと表面積が増加するにつれて、より重要になります。これが、オクタン(C₈H₁₈)のようなより大きな分子は室温で液体であるのに対し、メタン(CH₄)のようなより小さな分子は気体である理由です。

外部圧力の影響
外部圧力は物質に対する物理的な蓋のように作用し、分子が次の相(固体から液体、または液体から気体)へ逃げるのをより困難にします。
沸騰における圧力の役割
沸騰は、液体の内部蒸気圧が外部の大気圧と等しくなったときに起こります。
外部圧力を増加させる(例:圧力鍋を使用する)と、分子はそのより強い外部の力に逆らうためにより多くのエネルギーが必要になるため、沸点が上昇します。
逆に、外部圧力を減少させる(例:高地に行く)と、沸点が低下します。これが、水が海面よりもデンバーで低い温度で沸騰する理由です。
圧力の融点への影響
ほとんどの物質では、圧力をわずかに増加させると融点もわずかに上昇します。これは、圧力が分子が固体の硬く密に詰まった構造にとどまるのを助けるためです。
水はこの点で有名な例外です。固体氷は液体水よりも密度が低いため、圧力をかけると実際には融解が容易になります。これが、アイススケートの刃が氷の上を滑ることができる理由です。
一般的な落とし穴とニュアンス
単一の要因だけを見ても誤解を招く可能性があります。力、質量、形状の相互作用が重要なニュアンスを生み出します。
分子量 対 分子間力
沸点は一般的にモル質量とともに増加しますが、IMFの種類の方がはるかに支配的です。
強い水素結合を持つ小さな分子(例:水(18 g/mol、沸点100°C))は、弱い分散力しか持たない同様のサイズの分子(例:メタン(16 g/mol、沸点-161.5°C))よりもはるかに高い沸点を持ちます。
分子形状の影響
化学式が同じ分子(異性体)の場合、形状が重要です。長くまっすぐな分子は接触のための表面積が大きくなるため、より強いロンドン分散力とより高い沸点につながります。
コンパクトで球状の分子は表面積が小さいため、引力が弱く、沸点が低くなります。
正しい予測をする
これらの原理を組み合わせることで、異なる物質がなぜそのように振る舞うのかを正確に評価できます。
- 異なる物質を比較することが主な焦点である場合: まず、それぞれに存在する最も強い分子間力を特定します。これが、それらの相対的な沸点を決定するほぼ常に主要な決定要因となります。
- 単一物質の条件を変更することが主な焦点である場合: 外部圧力の変化が相転移(特に沸騰)に必要なエネルギーにどのように影響するかを分析します。
- 予期せぬ結果に遭遇した場合: 水に見られるような、分子形状や物質の特有の密度特性などの二次的な要因を考慮してください。
これらの核となる原理を理解することで、単に融点と沸点を暗記するだけでなく、物質の物理的挙動を真に理解する方向に進むことができます。
要約表:
| 要因 | 説明 | 融点/沸点への影響 |
|---|---|---|
| 分子間力(IMF) | 分子間の引力の強さ。 | 力が強いほど、ポイントは高くなる |
| 水素結合 | H-F、H-O、H-N結合を伴う強い力。 | 非常に高いポイント |
| 双極子-双極子 | 極性分子間の適度な力。 | 中程度のポイント |
| ロンドン分散力 | すべての分子に存在する弱い力で、サイズとともに増加する。 | 低いポイント(分子が大きくない限り) |
| 外部圧力 | 物質に加えられる圧力。 | 圧力が高くなるほど沸点が高くなる(通常) |
実験プロセスで正確な温度制御が必要ですか?相転移を理解することは、材料合成、化学精製、サンプル調製などのアプリケーションにとって極めて重要です。KINTEKでは、お客様の研究に求められる精度と信頼性を提供するように設計されたオーブン、炉、温度制御システムを含む高品質の実験装置を専門としています。当社の専門家が、お客様の特定のアプリケーションに最適な装置の選択をお手伝いします。お客様の実験室のニーズについて今すぐお問い合わせください!
ビジュアルガイド
関連製品
- 真空熱処理炉および浮上誘導溶解炉
- 真空誘導溶解スピニングシステム アーク溶解炉
- ラボスケール真空誘導溶解炉
- 加熱プレート付き自動加熱油圧プレス機(実験用ホットプレス 25T 30T 50T)
- ラボ用一体型手動加熱プレート付き加熱油圧プレス機






















