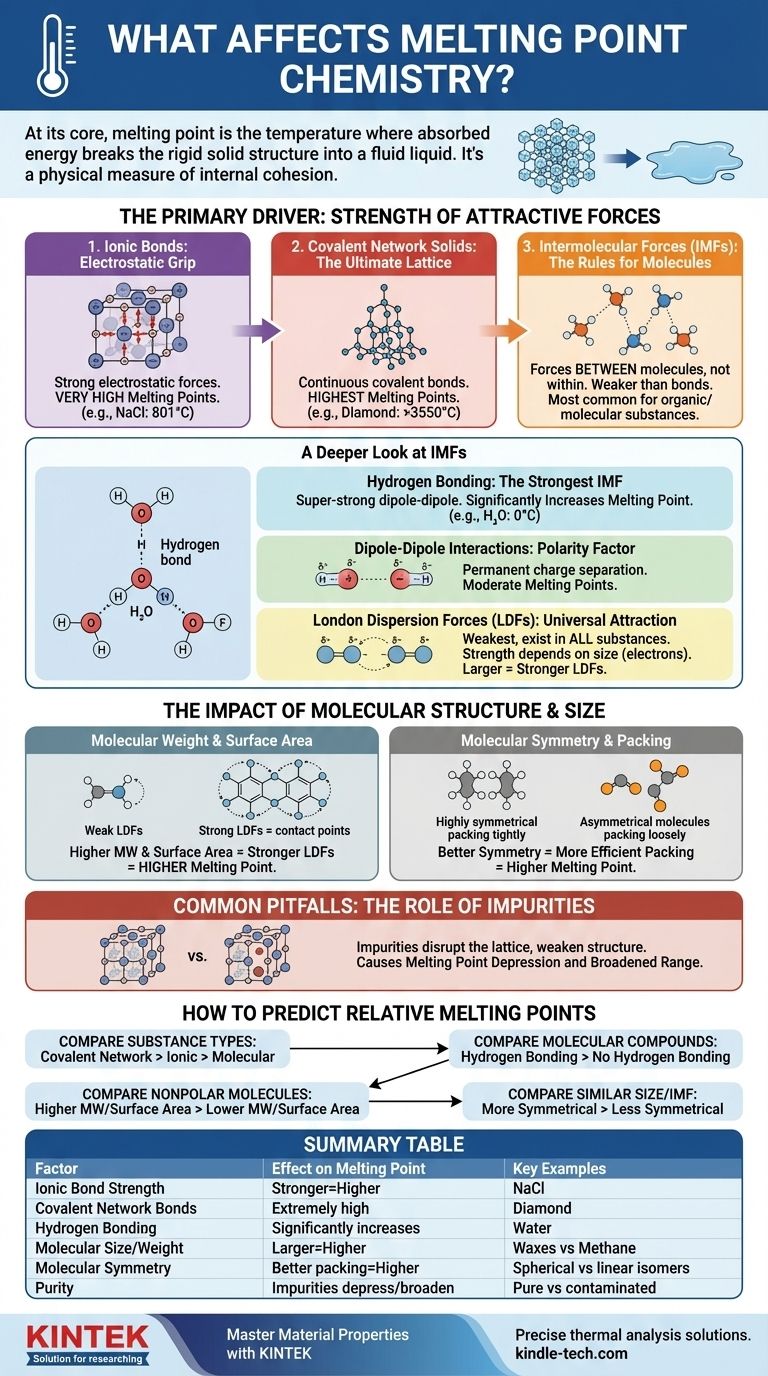
本質的に、物質の融点とは、固体が持つ剛直で秩序だった構造を破壊し、無秩序で流動的な液体へと相転移するのに十分なエネルギーを吸収した温度のことです。これは、粒子(原子、イオン、または分子)を互いに引きつけている引力の強さと、それらの粒子が結晶格子内にどれだけ効率的に詰まるかという、主に2つの要因によって決定されます。
融点は単なる数値ではなく、物質の内部結合の物理的な尺度です。それを理解するには、まず粒子を結合させている支配的な力(強力なイオン結合であれ、弱い分子間引力であれ)を特定し、次に分子のサイズと形状がその値をどのように微調整するかを考慮する必要があります。
主な原動力:引力の強さ
固体格子を破壊するために必要なエネルギー量は、格子を結合させている力の強さに直接比例します。これらの力は、非常に強力な化学結合から、はるかに弱い分子間力に至るまで、広大なスペクトル上に存在します。
イオン結合:静電的な把握力
食塩(NaCl)のようなイオン性化合物は、正イオンと負イオンの間の強力な静電引力によって結合しています。これらの力は非常に安定した結晶格子を形成します。
これらの強い引力を克服するには、莫大な熱エネルギーが必要となるため、イオン性化合物は通常、非常に高い融点を示します。
共有結合性ネットワーク固体:究極の格子
ダイヤモンドや石英(SiO₂)のような共有結合性ネットワーク固体では、原子はお互いに引きつけられているだけでなく、強力な共有結合の連続的なネットワークによって結合されています。分離すべき個々の分子は存在しません。
そのような物質を融解させるには、これらの強力な共有結合を破壊し始める必要があります。これには、他のどの種類の相互作用よりも多くのエネルギーが必要となるため、これらの材料はすべての物質の中で最も高い融点を持ちます。
分子間力(IMF):分子の規則
分子性化合物(水、砂糖、ワックスなど)の場合、融点は分子内の共有結合を切断することではありません。分子間の弱い引力を克服することに関係しています。これらは分子間力(IMF)として知られています。

分子間力(IMF)の詳細
IMFの種類と強さは、ほとんどの有機物質および分子性物質の融点を決定する最も重要な単一の要因です。これらは通常、完全な化学結合よりもはるかに弱いです。
水素結合:最も強力なIMF
これは、水素が窒素(N)、酸素(O)、フッ素(F)のような電気陰性度の高い原子と結合している場合に起こる、特別な超強力な双極子間相互作用です。
結果として生じる分子間の引力は重要です。水(H₂O)はその典型的な例であり、その水素結合により、そのサイズから予想されるよりもはるかに高い融点(0 °C)を示します。
双極子-双極子相互作用:極性の要因
極性分子は電荷の永続的な分離を持ち、小さな磁石のように正極と負極を形成します。これらの分子の「極」がお互いに引きつけ合います。
これらの力は、同程度の大きさの無極性分子間の力よりも強いため、中程度の融点につながります。
ロンドン分散力(LDF):普遍的な引力
LDFは最も弱い種類のIMFであり、**すべての物質**に存在します。これらは、分子の周りの電子分布のランダムで一時的な変動から生じ、一時的な双極子を形成します。
LDFの強さは、**分子のサイズ**(特に電子の数)に直接依存します。分子が大きいほど、電子雲は大きく「揺れやすく」なり、より分極しやすくなり、より強いLDFにつながります。これが、ワックスのような大きな無極性分子でも室温で固体でいられる理由です。
分子構造とサイズの影響
力の種類に加えて、分子の特定の形状とサイズが融点を微調整する上で重要な役割を果たします。
分子量と表面積
同じ支配的なIMFを持つ分子(例:2つの無極性分子の比較)の場合、**分子量が大きい**方がより強いLDFを持ち、したがって**融点が高く**なります。表面積が大きいほど、分子間の接触点が増え、LDFが強くなります。
分子の対称性とパッキング(充填)
対称性は大きな影響を与えます。高度に対称的な分子は、よくできたレゴブロックのように、より効率的かつ密に安定した結晶格子に詰め込まれることができます。
この密で秩序だった配置を破壊するには、より多くのエネルギーが必要です。したがって、より対称的な分子は、同じ組成式と重量を持つ異性体よりも、しばしば**著しく高い融点**を持つことになります。
避けるべき一般的な落とし穴:不純物の役割
実際的な文脈では、融点に影響を与える最も一般的な要因の1つは、サンプルの純度です。
結晶格子の破壊
不純物は、物質の結晶格子にきれいに収まらない異質な粒子です。これらは欠陥を導入し、全体の構造を弱めます。
格子がすでに破壊されているため、それを破壊するのに必要な**エネルギーが少なく**なり、融点が低下します。この現象は**融点降下**として知られています。
融解範囲の広がり
純粋な物質は通常、非常に狭い温度範囲(しばしば1 °C未満)で融解します。不純物の存在は融点を下げるだけでなく、物質がより**広く、広い温度範囲**で融解する原因ともなります。化学者はこの特性を利用して、合成化合物の純度を評価します。
相対的な融点を予測する方法
2つの物質を比較する場合、正確な予測をするために、この階層的な質問リストに従ってください。
- 異なる物質タイプを比較する場合:共有結合性ネットワーク固体(ダイヤモンド)は、イオン性化合物(塩)よりも融点が高く、分子性化合物(砂糖)よりもはるかに高くなります。
- 2つの分子性化合物を比較する場合:まず水素結合の有無を確認します。サイズが同程度であれば、水素結合を形成できる分子の方が、形成できない分子よりもほぼ確実に融点が高くなります。
- 2つの無極性分子を比較する場合:分子量が大きく、表面積が大きい分子の方が、ロンドン分散力が強く、融点が高くなります。
- 2つの同程度のサイズでIMFタイプが同じ分子を比較する場合:結晶格子により効率的に充填できる、より対称的な分子の方が融点が高くなる可能性が高いです。
これらの要因を理解することで、融点は単なるデータポイントから、物質の基本的な分子力と構造を示す強力な指標へと変わります。
要約表:
| 要因 | 融点への影響 | 主な例 |
|---|---|---|
| イオン結合の強さ | 結合が強いほど融点が高い | 塩化ナトリウム(NaCl):801°C |
| 共有結合性ネットワーク結合 | 極めて高い融点 | ダイヤモンド:>3550°C |
| 水素結合 | 融点を著しく上昇させる | 水(H₂O):0°C |
| 分子サイズ/重量 | 分子が大きいほど融点が高い(LDFが強い) | ワックス(高MW) vs. メタン(低MW) |
| 分子の対称性 | 充填効率が良いほど融点が高い | 球状異性体 vs. 直鎖状異性体 |
| 純度 | 不純物は融点を降下させ、範囲を広げる | 純粋なサンプル vs. 汚染されたサンプル |
KINTEKで材料特性をマスターする
融点の理解は、実験室での材料選定、合成、品質管理にとって極めて重要です。新しい化合物の開発であれ、材料の純度分析であれ、適切な機器を備えていることが不可欠です。
KINTEKは、正確で信頼性の高い熱分析を実現するために設計された、高品質の実験装置および消耗品を専門としています。当社の製品は、研究者やラボの専門家が融点を正確に決定し、材料の挙動を理解するのに役立ちます。
ラボの能力を向上させる準備はできましたか? 当社の専門家へ今すぐお問い合わせいただき、熱分析のニーズに最適なソリューションを見つけてください。
ビジュアルガイド