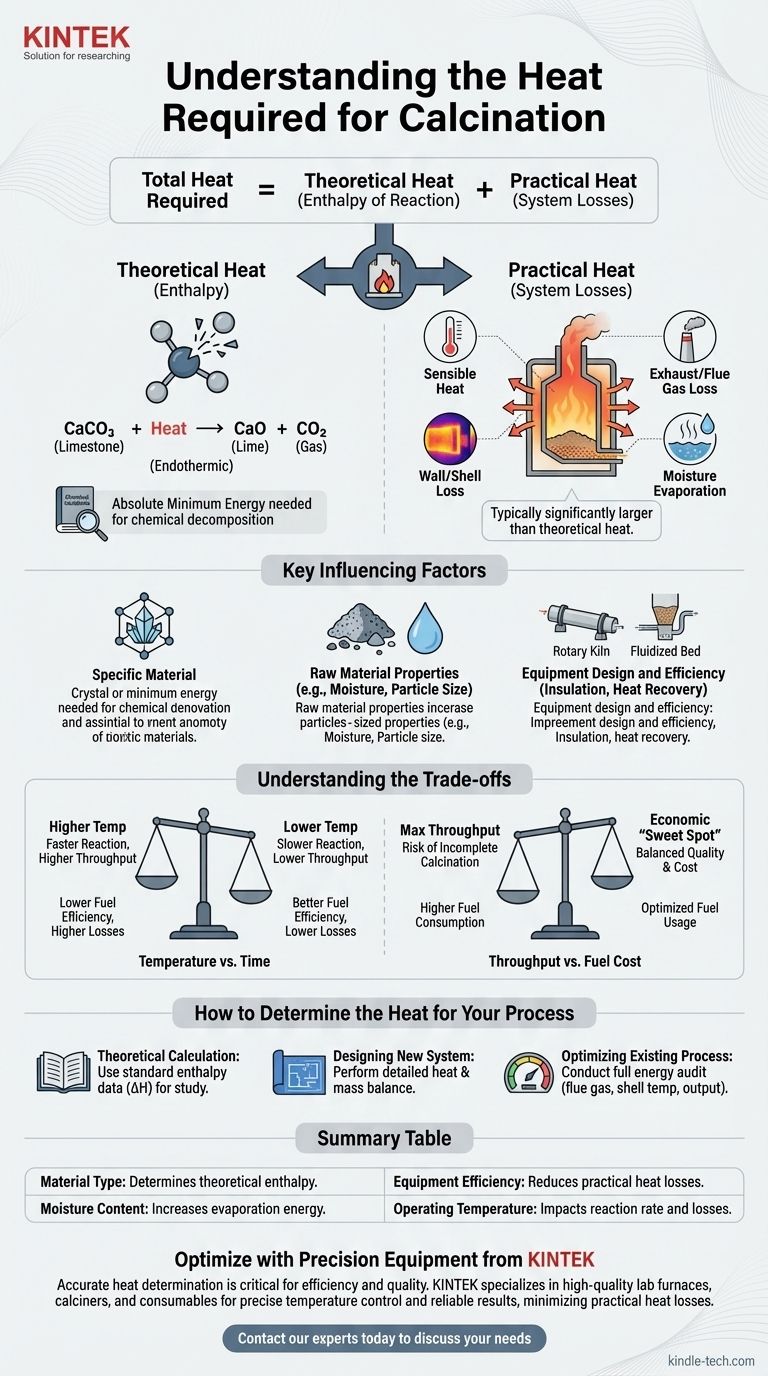
焼成に必要な熱量は、単一の普遍的な値ではありません。これは、処理される特定の材料、基礎となる化学反応、および炉や焼成炉などの使用される装置の効率に完全に依存する可変量です。この値を計算するには、化学原理と現実世界のシステム非効率性の両方を理解する必要があります。
焼成プロセスに必要な総熱量は、2つの異なる要素の合計です。材料の化学結合を切断するために必要な理論的な反応熱と、運用システムに固有の実用的な熱損失です。成功する分析には、この両方を考慮する必要があります。
焼成熱の2つの要素
焼成のエネルギー需要を理解するには、理論上の最小値と産業用装置の現実的な側面を区別する必要があります。
理論熱(反応エンタルピー)
これは、化学の法則によって分解反応を駆動するために必要な絶対最小量のエネルギーです。
この値は、特定の化学変換に対して固定されています。例えば、石灰石(炭酸カルシウム、CaCO₃)を焼成して生石灰(酸化カルシウム、CaO)と二酸化炭素(CO₂)を生成する反応は吸熱反応であり、進行するためには特定の量のエネルギーを吸収する必要があります。
この理論的なエネルギー要件は、ほとんどの一般的な材料について、化学工学ハンドブックで計算または見つけることができます。
実用熱(システム損失)
これは、理論上の最小値を超えて、実際のシステムに供給しなければならない追加のエネルギーすべてです。ほとんどの産業運転では、この要素は理論的な反応熱よりもはるかに大きくなります。
実用的な熱損失の主な原因は次のとおりです。
- 顕熱:材料自体を必要な反応温度まで加熱するために使用されるエネルギー。
- 排気/煙道ガス損失:焼成炉から排出される高温ガスによって運ばれる熱。
- 壁/シェル損失:炉やキルンの外面から放射および対流によって失われる熱。
- 水分蒸発:焼成反応が始まる前に、原料に含まれる水分を蒸気に変えるために消費されるエネルギー。

熱要件に影響を与える主な要因
最終的なエネルギー消費量は、いくつかの相互作用する変数の結果です。これらの要因を理解することは、プロセス設計と最適化にとって非常に重要です。
特定の材料
異なる材料は、化学結合や分解温度が大きく異なります。石膏から水を追い出すのに必要なエネルギーは、炭酸カルシウムを分解するのに必要なエネルギーよりもはるかに少ないです。
原料の特性
材料の物理的状態が重要です。微粉末は大きな岩石よりも均一に加熱され、高い初期水分含有量は、水の高い蒸発熱のためにエネルギー消費を劇的に増加させる可能性があります。
装置の設計と効率
ロータリーキルン、シャフト炉、または流動層焼成炉など、使用される装置の種類は熱伝達に大きな影響を与えます。
断熱材の品質、エアシールの有効性、熱回収システム(高温排ガスを使用して投入材料を予熱する予熱器など)の存在などの要因は、全体的な熱効率の主要な推進力となります。
トレードオフの理解
焼成プロセスの最適化には、競合する運用目標のバランスを取ることが含まれます。これらのトレードオフを無視すると、非効率性や製品品質の低下につながることがよくあります。
温度 vs. 時間
高い運転温度は焼成反応を加速し、スループットを向上させることができます。しかし、これは多くの場合、装置のシェルや煙道ガスからの熱損失を増加させ、燃料効率を低下させます。
逆に、低温はエネルギーを節約しますが、材料が焼成炉内でより長い時間を費やす必要があり、生産速度を制限する可能性があります。
スループット vs. 燃料費
最大生産量を追求すると、焼成が不完全になったり、システムに大量の燃料を投入する必要が生じ、全体的な効率が急落する可能性があります。
経済的な「スイートスポット」を見つけるには、最終製品の価値と1トンあたりの燃料消費コストを慎重に比較検討する必要があります。
プロセスの熱量を決定する方法
単一の公式はありませんが、特定の目的に焦点を当てることで熱要件を決定できます。
- 研究のための理論計算が主な焦点である場合:特定の化学分解の標準反応エンタルピー(ΔH)を熱力学データ参照で探してください。
- 新しいシステムの設計が主な焦点である場合:材料の特性、装置の仕様、およびすべての潜在的な熱損失を考慮した詳細な熱収支および物質収支を実行する必要があります。
- 既存のプロセスの最適化が主な焦点である場合:煙道ガス温度、製品出力、シェル温度を測定して、主要な熱損失源を特定し定量化するために、装置の完全なエネルギー監査を実施してください。
最終的に、焼成熱を正確に決定することは、単一の数値を超えて、特定の材料とシステムの包括的な分析へと進みます。
要約表:
| 要因 | 熱要件への影響 |
|---|---|
| 材料の種類 | 理論反応エンタルピーを決定します(例:石灰石 vs. 石膏)。 |
| 水分含有量 | 水分が多いと、蒸発に必要なエネルギーが大幅に増加します。 |
| 装置の効率 | 断熱性が高く、熱回収システムが優れていると、実用的な熱損失が減少します。 |
| 運転温度 | 温度が高いと反応速度が速くなる可能性がありますが、熱損失も増加します。 |
KINTEKの精密機器で焼成プロセスを最適化しましょう。
熱要件を正確に決定することは、効率と製品品質にとって不可欠です。新しいシステムを設計する場合でも、既存のシステムを最適化する場合でも、正確な熱分析と材料試験には適切な実験装置が不可欠です。
KINTEKは、研究開発に必要な正確な温度制御と信頼性を提供する高品質の実験用炉、焼成炉、消耗品を専門としています。当社のソリューションは、実用的な熱損失を最小限に抑え、最適な結果を達成するのに役立ちます。
今すぐ専門家にお問い合わせください。特定の焼成ニーズについて話し合い、KINTEKがお客様のラボの能力をどのように向上させることができるかを発見してください。
ビジュアルガイド