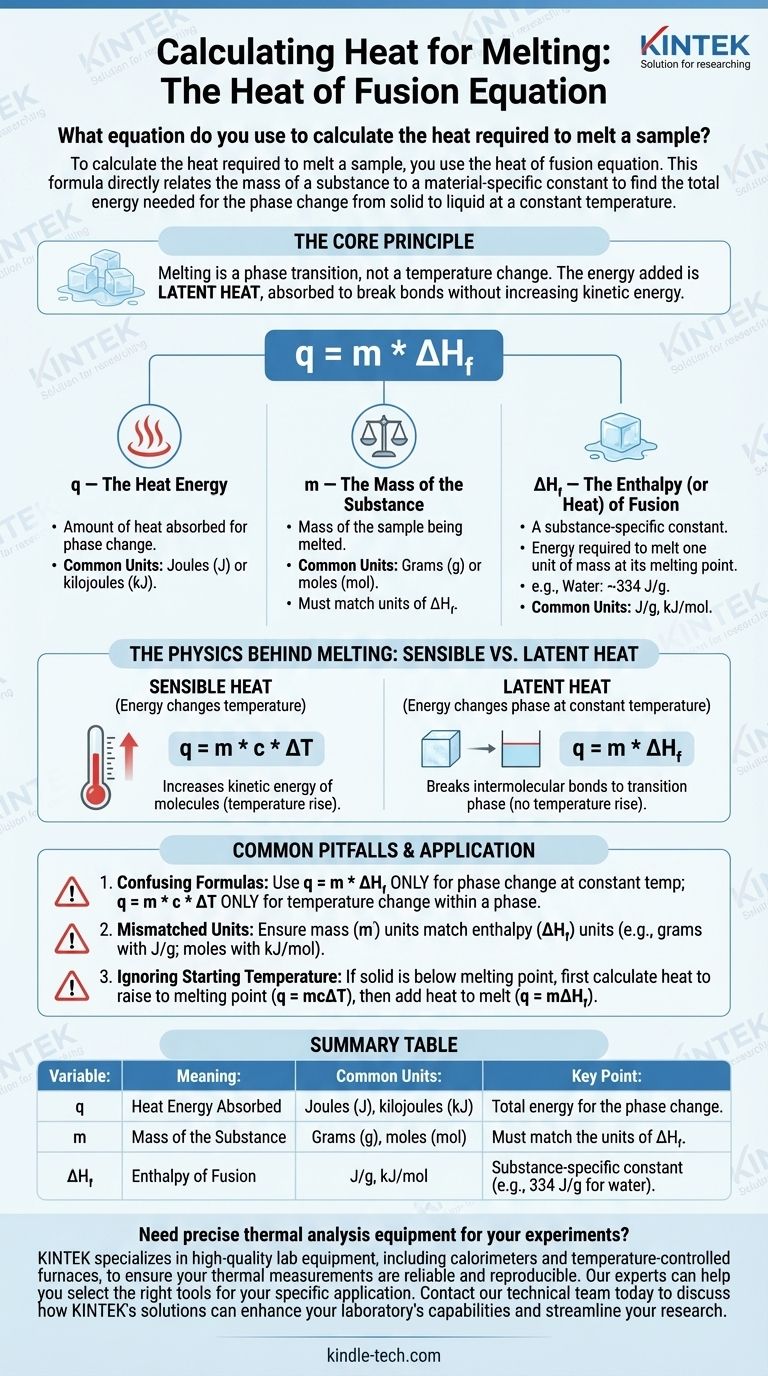
試料を融解させるのに必要な熱量を計算するには、融解熱の式を使用します。この公式は、物質の質量と物質固有の定数を直接関連付け、一定温度で固体から液体への相変化に必要な総エネルギーを求めます。
核となる原理は、融解は温度変化ではなく相転移であるということです。加えるエネルギーは潜熱と呼ばれ、分子の運動エネルギーを増加させることなく、固体構造の結合を切るために吸収されます。
融解熱の式の解体
融解中に吸収される熱量を計算する式は次のとおりです。
q = m * ΔH_f
この方程式の各変数は、物理プロセスの重要な部分を表しています。それらを個別に理解することが、公式を正しく適用するための鍵となります。
q — 熱エネルギー
q は、物質が相変化を起こすために吸収する熱量を表します。この値は通常、ジュール (J) またはキロジュール (kJ) で表されますが、古い文脈ではカロリー (cal) が使用されることもあります。
m — 物質の質量
m は、融解させる試料の質量です。質量単位(通常はグラム (g) またはモル (mol))が、その物質の融解熱定数で使用される単位と一致していることが重要です。
ΔH_f — エンタルピー(または熱)融解熱
ΔH_f が最も重要な変数です。これは融解エンタルピー、または潜熱融解熱と呼ばれることもあります。
これは各物質に固有の物理定数です。それは、融点においてその物質の単位質量(例えば、1グラムまたは1モル)を融解させるのに必要なエネルギー量を定義します。
例えば、水の融解熱は約 334 ジュール/グラム (J/g) です。これは、0℃の氷1グラムを0℃の液体水1グラムに融解させるには、334ジュールのエネルギーを加える必要があることを意味します。

融解の物理学:顕熱と潜熱
融解中に温度が上昇しない理由については、よく混乱が生じます。これは、2種類の熱エネルギーの違いによって説明されます。
顕熱
顕熱は、物質の温度を変化させるエネルギーです。顕熱を加えると、分子の運動エネルギーが増加し、分子がより速く動き、これを温度上昇として測定します。この式は q = m * c * ΔT です。
潜熱
潜熱は、一定温度での相変化中に吸収または放出されるエネルギーです。融解中、流入するエネルギーは、固体の結晶格子を結びつけている分子間結合を切断するために完全に使われ、液体に変化します。
エネルギーは温度上昇を引き起こすのではなく、相変化の中に「隠されている」ため、潜熱と呼ばれます。
避けるべき一般的な落とし穴
間違った概念や公式を適用することは、熱力学的計算における頻繁なエラーの原因となります。これらの一般的な間違いに注意してください。
融解熱と比熱の混同
最も一般的な間違いは、間違った公式を使用することです。
q = m * ΔH_f(融解熱) は、一定温度での相変化(例:0℃での氷の融解)にのみ使用します。q = m * c * ΔT(比熱) は、単一相内での物質の温度変化(例:-10℃から0℃への固体の氷の加熱)にのみ使用します。
単位の不一致
常に単位を確認してください。質量 (m) がグラムの場合、融解熱 (ΔH_f) はジュール/グラム (J/g) でなければなりません。ΔH_f がキロジュール/モル (kJ/mol) で与えられている場合は、まず試料の質量をモルに変換する必要があります。
開始温度の無視
融解熱の式は、物質がすでに融点にある場合にのみ適用されます。融点以下の固体がある場合は、2段階の計算を実行する必要があります。
- 固体を融点まで上昇させるのに必要な熱量を計算します (
q = mcΔT)。 - 融点にある固体を融解させるのに必要な熱量を計算します (
q = mΔH_f)。 - 合計熱量を得るために結果を合計します。
計算に正しい公式を適用する
問題を正しく解決するために、計算する必要がある正確なプロセスを特定してください。
- 融点にある物質を融解させることに主眼を置く場合:融解熱の式
q = m * ΔH_fのみが必要です。 - 相変化なしに物質を加熱することに主眼を置く場合:比熱容量の式
q = m * c * ΔTのみが必要です。 - 固体を加熱し、その後完全に融解させることに主眼を置く場合:両方のステップの熱量を個別に計算し、それらを合計する必要があります:
q_total = (m * c * ΔT)_加熱 + (m * ΔH_f)_融解。
どの物理プロセスをモデル化しているかを理解することが、適切な方程式を選択する鍵となります。
要約表:
| 変数 | 意味 | 一般的な単位 | 重要な点 |
|---|---|---|---|
| q | 吸収された熱エネルギー | ジュール (J)、キロジュール (kJ) | 相変化のための総エネルギー |
| m | 物質の質量 | グラム (g)、モル (mol) | ΔH_f の単位と一致させる必要があります |
| ΔH_f | 融解エンタルピー | J/g、kJ/mol | 物質固有の定数(例:水の場合 334 J/g) |
実験用の精密な熱分析装置が必要ですか?
熱量要件を正確に計算することは、材料科学、化学、製薬において不可欠です。KINTEKは、熱測定の信頼性と再現性を確保するために、熱量計や温度制御炉などの高品質な実験装置を専門としています。
相変化、材料合成、反応速度論のいずれを研究している場合でも、当社の専門家がお客様の特定の用途に合った適切なツールを選択するお手伝いをいたします。
今すぐ当社の技術チームにご連絡ください KINTEKのソリューションがお客様の研究室の能力をどのように向上させ、研究を合理化できるかについてご相談ください。
ビジュアルガイド
関連製品
- ラボ用一体型手動加熱プレート付き加熱油圧プレス機
- ラボ用ホットプレス用加熱プレート付き24T 30T 60T 加熱油圧プレス機
- 実験室用円筒型電気加熱プレス金型
- 加熱プレート付き自動加熱油圧プレス機(実験用ホットプレス 25T 30T 50T)
- ラボ赤外線プレス金型
よくある質問
- 焼結はどのように行われますか?粉末を固体部品に融合させるためのステップバイステップガイド
- 薄膜の厚さとは?材料性能を左右する重要な設計パラメータ
- 表面硬化にはどのような製品がありますか?プロセス、薬剤、用途のガイド
- 生体材料の表面改質における超音波洗浄装置の役割は何ですか?接着力の向上
- 吸着速度論において、恒温振盪機が必要なのはなぜですか? 信頼性の高い銅(II)イオン相互作用データを保証する
- KBrがペレット作成に使用されるのはなぜですか?固形サンプルの高品質なFTIR分析を実現する
- 合金実験における1℃/分の冷却速度の重要性とは?応力を軽減し、SEMデータの精度を確保する
- 実生活における不活性ガスの例にはどのようなものがありますか?風船から溶接まで、その用途を発見


























