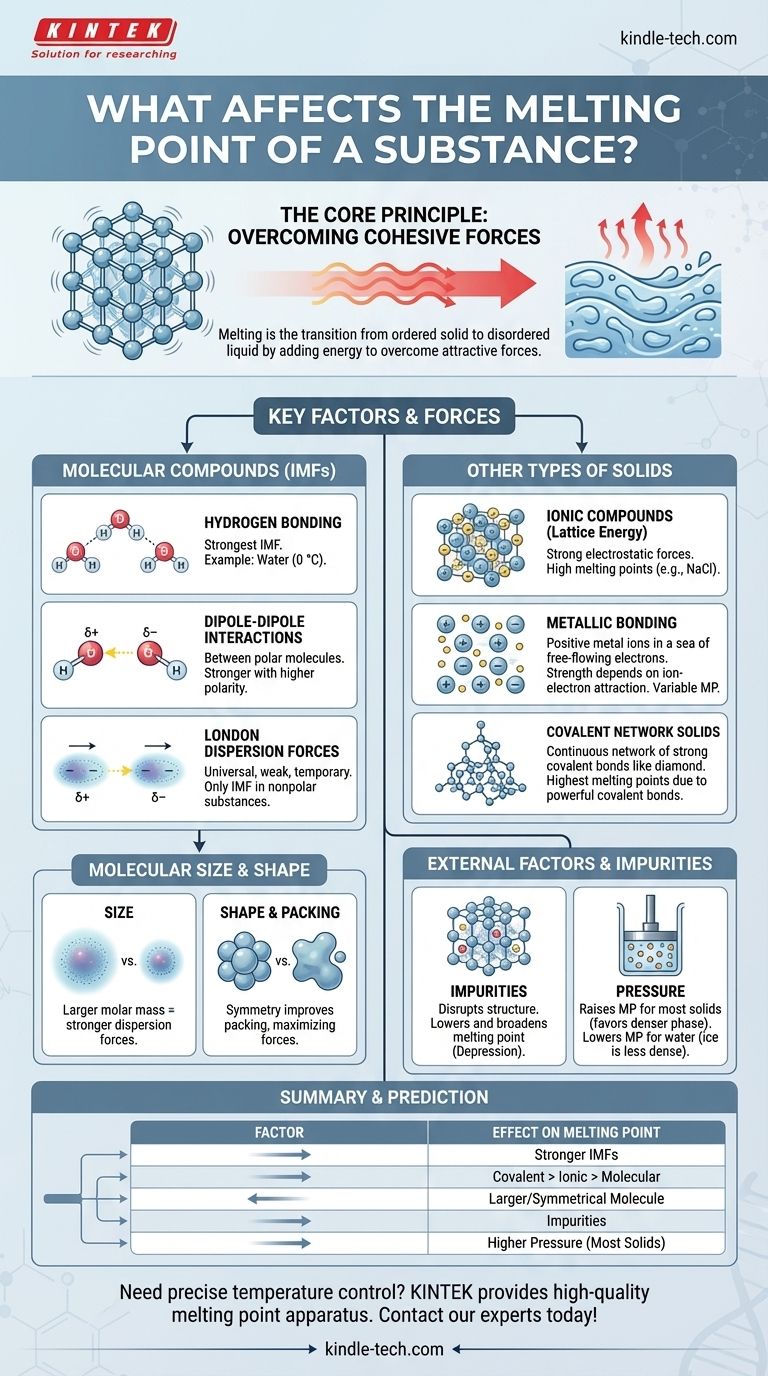
本質的に、物質の融点は、その粒子を固定された三次元構造に保持している引力を克服するために必要なエネルギーによって決まります。主な要因は、これらの力の強さ(化学結合か、より弱い分子間力か)と、粒子の配列の仕方です。分子のサイズ、形状、不純物の存在なども重要な役割を果たします。
中心となる原理は単純です。粒子間の引力が強いほど、それを破壊するために必要な熱エネルギーが大きくなり、融点が高くなります。融点の物語全体は、これらの力がどのように生成され、修正されるかの探求なのです。
核心原理:凝集力の克服
融解は、秩序ある固体状態から無秩序な液体状態への物理的変化です。この遷移を理解することが、それを制御する要因を理解するための鍵となります。
融解とは何か?
固体中では、原子、イオン、または分子は結晶格子と呼ばれる固定された配列に固定されています。それらはその場で振動しますが、互いに移動することはありません。
融解は、これらの粒子が熱から十分な運動エネルギーを得て、固定位置から解放され、流れ始める特定の温度で起こります。
エネルギー vs. 凝集力
物質に加える熱は粒子の運動エネルギーを増加させ、それらの振動をより激しくさせます。融点は、この振動エネルギーが格子を保持している凝集力を克服するのに十分強力になる平衡温度です。

分子性化合物の主な要因
個々の分子(水、ワックス、砂糖など)で構成される物質の場合、融解中に破壊されるのは分子内の結合ではなく、分子間の力です。これらは分子間力(IMF)と呼ばれます。
水素結合:最も強いIMF
水素結合は、水素が窒素(N)、酸素(O)、フッ素(F)などの電気陰性度の高い原子に結合している場合に発生する強力な双極子間相互作用の一種です。
水(H₂O)はその典型的な例です。同様のサイズの分子と比較して融点(0℃)が高いのは、氷の中で分子を保持している強い水素結合ネットワークによるものです。
双極子-双極子相互作用
これらの力は、永久的な部分的な正の端と負の端を持つ極性分子間に存在します。ある分子の正の端が隣の分子の負の端を引き付けます。
分子の極性が大きいほど、双極子-双極子引力は強くなり、融点も高くなります。
ロンドン分散力:普遍的な力
これらの一時的で弱い引力は、極性分子と無極性分子の**すべて**の分子に存在します。これらは、分子の電子雲における一時的な変動によって生じ、一時的な双極子を生成します。
メタン(CH₄)やオクタン(C₈H₁₈)などの無極性物質の場合、ロンドン分散力が唯一存在するIMFです。
分子のサイズと形状の役割
サイズ(モル質量): 分子が大きいほど電子雲が大きくなり、歪みやすくなります。これによりロンドン分散力が強くなり、結果として融点が高くなります。これが、大きなワックス状の炭化水素が室温で固体であるのに対し、メタンのような小さな炭化水素が気体である理由です。
対称性とパッキング: 対称的でコンパクトな分子は、結晶格子により密に効率的に充填できます。この密な充填は分子間力の効果を最大化し、同じサイズの不規則な形状の異性体よりも高い融点をもたらします。
分子を超えて:その他の種類の固体
すべての固体が個々の分子でできているわけではありません。多くの材料では、融解には構造全体に及ぶ強力な化学結合を切断する必要があります。
イオン化合物と格子エネルギー
食塩(NaCl)などのイオン化合物では、正イオンと負イオンが強い静電力(イオン結合)によって剛直な格子内に保持されています。これらの物質を融解させるには、格子エネルギーによって測定されるこの巨大な引力を克服する必要があります。
イオン結合は分子間力よりもはるかに強いため、イオン化合物の融点は非常に高くなります。
金属と金属結合
金属は、固定された正の金属イオンの格子の中で非局在化電子の「海」が自由に流れる金属結合によって結合されています。
イオンとこの電子の海との間の引力の強さが融点を決定します。タングステンやチタンなどの金属は非常に強い金属結合を形成し、例外的に高い融点を持ちます。
共有結合性ネットワーク固体
これらの材料では、原子が強力な共有結合の連続的なネットワークによって結合されています。個々の分子は存在しません。
ダイヤモンド(炭素)や石英(二酸化ケイ素)などの共有結合性ネットワーク固体を融解させるには、これらの強力な共有結合を切断する必要があります。これには膨大なエネルギーが必要であり、あらゆる種類の物質の中で最も高い融点をもたらします。
トレードオフと外部要因の理解
物質の固有の特性だけが影響を与えるわけではありません。外部条件や組成も重要な影響を及ぼします。
不純物の影響:融点降下
不純物の存在は、結晶格子の均一な構造を乱します。この弱く、無秩序になった格子は、破壊されるためにより少ないエネルギーしか必要としません。
この現象は融点降下として知られています。純粋な物質が鋭く明確な融点を示すのに対し、不純物を含む物質が広い低い温度範囲で融解するのはこのためです。また、冬の道路の氷を溶かすために塩を使用するのもこの原理に基づいています。
圧力の影響
ほとんどの物質では、固体相は液体相よりも密度が高いです。圧力を上げると密度の高い状態が促進され、粒子が互いに近づき、解放されにくくなります。したがって、ほとんどの材料では、圧力が高くなると融点も上昇します。
水はこの有名な例外です。氷は液体水よりも密度が低いため、圧力を上げると液体状態が促進され、それによって融点が低下します。
相対的な融点を予測する方法
これらの原理を使用して、異なる物質を比較し、その挙動を予測します。
- 共有結合性ネットワーク、イオン、分子性化合物を比較する場合: 共有結合性ネットワーク(例:ダイヤモンド)が最も高く、次にイオン(例:塩)、分子性化合物(例:砂糖)がはるかに低くなります。
- 分子性化合物を比較する場合: まず、支配的な要因である水素結合の有無を確認します。水素結合がない場合は、極性を比較します。すべて無極性であるか、極性が類似している場合は、モル質量の大きい方が一般的に融点が高くなります。
- イオン化合物を比較する場合: イオンの電荷が高い、および/またはイオン半径が小さい化合物ほど、格子エネルギーが強く、融点が高くなります。
- 純度を評価する必要がある場合: 既知の融点でシャープに融解する物質は純粋である可能性が高く、予想される融点より低い範囲で徐々に融解する物質は不純物を含んでいます。
これらの基本的な力を理解することで、物質の微視的な構造がその融解挙動をどのように決定するかを効果的に予測できます。
要約表:
| 要因 | 融点への影響 | 主要原理 |
|---|---|---|
| 分子間力(IMF) | IMFが強いほど高くなる | 水素結合 > 双極子-双極子 > ロンドン分散力 |
| 化学結合の種類 | 共有結合性ネットワーク > イオン > 金属 > 分子性 | 破壊される結合の強さ |
| 分子のサイズ/形状 | モル質量が大きく、形状が対称的であるほど高くなる | ロンドン力を増加させ、格子パッキングを改善する |
| 不純物 | 低下する(融点降下) | 結晶格子を乱し、融解に必要なエネルギーを減少させる |
| 圧力 | (ほとんどの固体で)上昇する;(氷/水では)低下する | より密度の高い相(ほとんどの場合は固体、水の場合は液体)を優先する |
材料分析のための正確な温度制御が必要ですか? 融点を理解することは、材料特性評価、純度評価、プロセス開発にとって極めて重要です。KINTEKは、融点測定装置や炉を含む高品質なラボ機器を提供し、お客様のラボが正確で信頼性の高い結果を達成できるよう支援することに特化しています。 お客様の特定の用途に最適なソリューションを見つけるために、今すぐ専門家にご連絡ください!
ビジュアルガイド