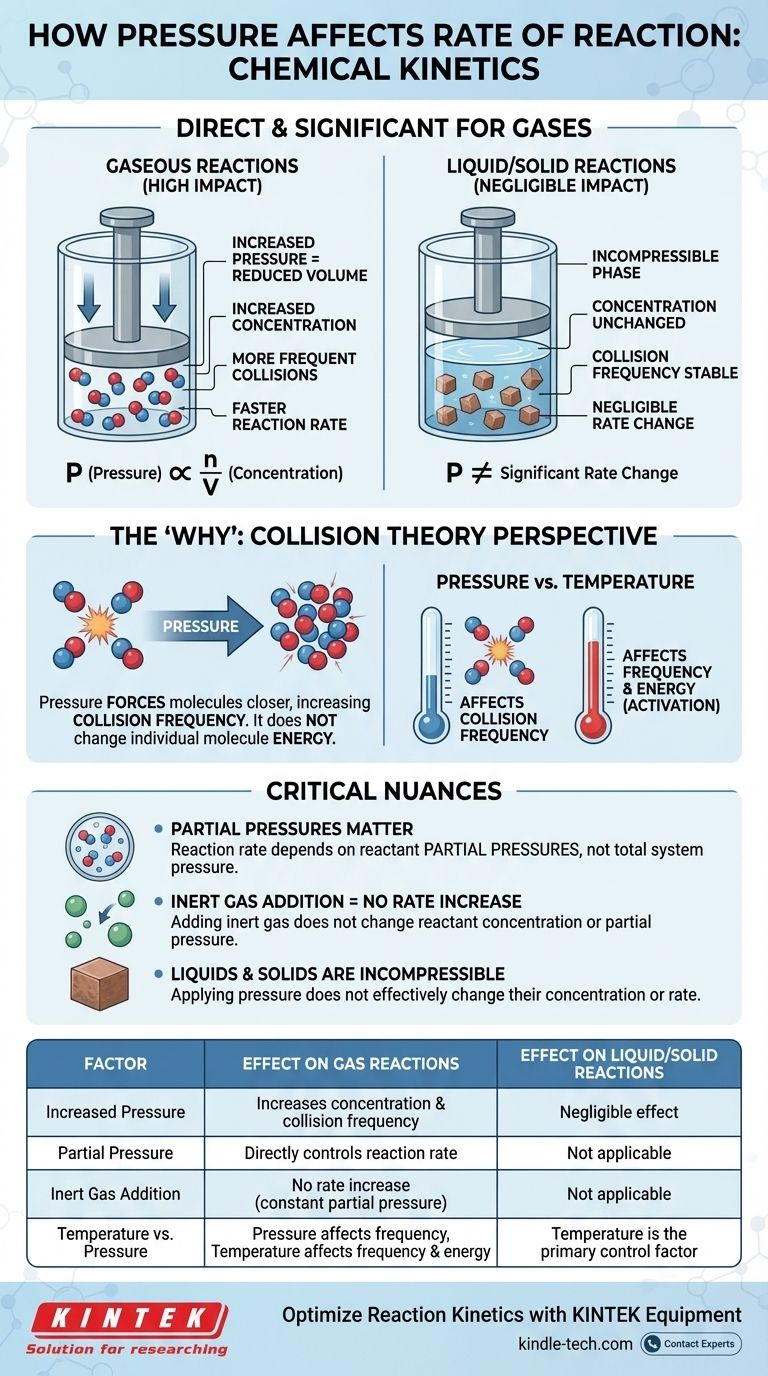
化学反応速度論において、圧力の反応速度への影響は直接的かつ重要ですが、これは気体を含む反応に限られます。 気体反応の場合、圧力を上げると反応物分子の濃度が増加します。これにより、分子間の衝突頻度が高まり、結果として反応の全体的な速度が向上します。純粋に液体または固体の相で起こる反応では、圧力は速度にほとんど影響を与えません。
圧力と反応速度の関係は、根本的には濃度に関する物語です。気体の場合、圧力を上げることは、同じ体積により多くの分子を押し込み、有効衝突の頻度を増やし、それによって反応を加速させる物理的な手段にすぎません。
基本的なつながり:濃度を代行する圧力
圧力が気体反応に影響を与える核心的な理由は、濃度との直接的な関係にあります。この原理は、化学の基礎法則を見ることで最もよく説明されます。
理想気体法則の役割
理想気体法則 PV = nRT は、数学的なつながりを提供します。これを圧力について解くと (P = (n/V)RT)、圧力 (P) が n/V に直接比例することがわかります。
n/V という項は、単位体積 (V) あたりのモル数 (n) を表し、これはモル濃度のまさに定義です。したがって、一定温度で系の圧力を上げると、系内の気体分子の濃度が直接増加します。
濃度が反応速度をどのように支配するか
反応の速度は、その速度法則によって定義され、しばしば rate = k[A]^m[B]^n と表されます。この式では、[A] と [B] は反応物の濃度を表します。
速度法則は、反応速度が反応物の濃度に直接依存することを示しています。濃度が高いほど、速度は速くなります。これを気体法則と結びつけると、一連の出来事が明確になります。つまり、圧力を上げると濃度が増加し、それが反応速度を増加させるのです。

変化の「理由」:衝突理論の観点
速度法則は何が起こるかを教えてくれますが、衝突理論は分子レベルでなぜそれが起こるかを説明します。反応が起こるためには、反応物粒子が十分なエネルギーと正しい配向の両方で衝突する必要があります。
衝突頻度の原理
化学反応は、無数の分子衝突の結果です。1秒あたりに発生する衝突が多いほど、成功する反応が起こる機会が多くなります。
圧力が衝突を促進する方法
気体に圧力を加えると、占める体積が減少し、分子がより密接に押し込められます。これにより、それらの衝突頻度、つまり単位時間あたりに互いにぶつかる回数が劇的に増加します。
圧力は個々の分子のエネルギーを変えませんが(それは温度の役割です)、総衝突イベントの数を増やします。この頻度の増加は、成功した、反応を引き起こす衝突の比例的な増加につながります。
ニュアンスとトレードオフを理解する
一般的な規則は当てはまりますが、専門家はそれが適用される特定の条件、そしてより重要なことに、適用されない条件を理解する必要があります。
分圧の重要な役割
気体の混合物では、全体の反応速度は、系の全圧ではなく、特定の反応物の分圧に依存します。分圧とは、単一の気体が全容積を単独で占めた場合に及ぼす圧力です。
これは、反応容器に不活性ガス(アルゴンや窒素など)を追加することで全圧を上げることができることを意味します。しかし、これは実際の反応物の濃度や分圧を変えないため、反応速度を増加させることはありません。
液体と固体への影響はごくわずか
圧力は、凝縮相(液体および固体)の反応速度にはごくわずかな影響しか与えません。これらの物質の状態は、すでに非圧縮性と見なされています。
液体や固体中の分子はすでに密接に詰まっています。外部圧力を加えても、分子間の距離が大幅に減少したり、濃度が変化したりすることはありません。したがって、それらの反応速度を変えるための効果的な手段ではありません。
圧力と温度
圧力と温度の影響を区別することが重要です。
- 圧力は主に衝突の頻度に影響を与えます。
- 温度は衝突の頻度(分子が速く動く)と、より重要なことに、各衝突のエネルギーの両方に影響を与えます。
温度を上げると、必要な最小活性化エネルギーを持つ分子の割合が増加するため、圧力よりも反応速度を増加させるはるかに強力な要因となります。
システムに最適な選択をする
この原理を理解することで、特定の目標に基づいて反応結果を制御できます。化学プロセスを設計または最適化する際には、以下を考慮してください。
- 気体反応の速度を最大化することが主な焦点である場合: システムの体積を減らして圧力を上げることは、スループットを向上させる直接的かつ効果的な方法です。
- 気体混合物中の反応を制御することが主な焦点である場合: 反応物の分圧を管理する必要があります。単に不活性ガスを追加して全圧を上げても、目的の反応は加速されません。
- 液体または固体中の反応速度を変更することが主な焦点である場合: 圧力を操作することは実行可能な戦略ではありません。温度、溶解種の濃度を変更するか、触媒を使用することに焦点を当てるべきです。
圧力が気体中の濃度の代行であることを理解することで、システムの反応速度を正確に制御できます。
要約表:
| 要因 | ガス反応への影響 | 液体/固体反応への影響 |
|---|---|---|
| 圧力増加 | 濃度と衝突頻度を増加させる | ごくわずかな影響(非圧縮性) |
| 分圧 | 反応速度を直接制御する | 該当なし |
| 不活性ガス添加 | 速度増加なし(分圧一定) | 該当なし |
| 温度 vs. 圧力 | 圧力は頻度に影響。温度は頻度とエネルギーに影響 | 温度が主要な制御要因 |
化学反応を正確に制御する必要がありますか? KINTEKは、圧力反応器やガス処理システムを含む高品質の実験装置を専門とし、反応速度論を最適化し、研究室で優れた結果を達成するお手伝いをします。今すぐ当社の専門家にお問い合わせください。お客様の特定のアプリケーションについて話し合い、ニーズに合った適切なソリューションを見つけてください。
ビジュアルガイド
関連製品
- 高度な科学および産業用途向けのカスタマイズ可能な高圧反応器
- 実験用ミニSS高圧オートクレーブ反応器
- ステンレス製高圧オートクレーブ反応器 実験室用圧力反応器
- 熱水合成用高圧実験室オートクレーブ反応器
- コールドアイソスタティックプレス用電気分割ラボコールドアイソスタティックプレスCIP装置



















