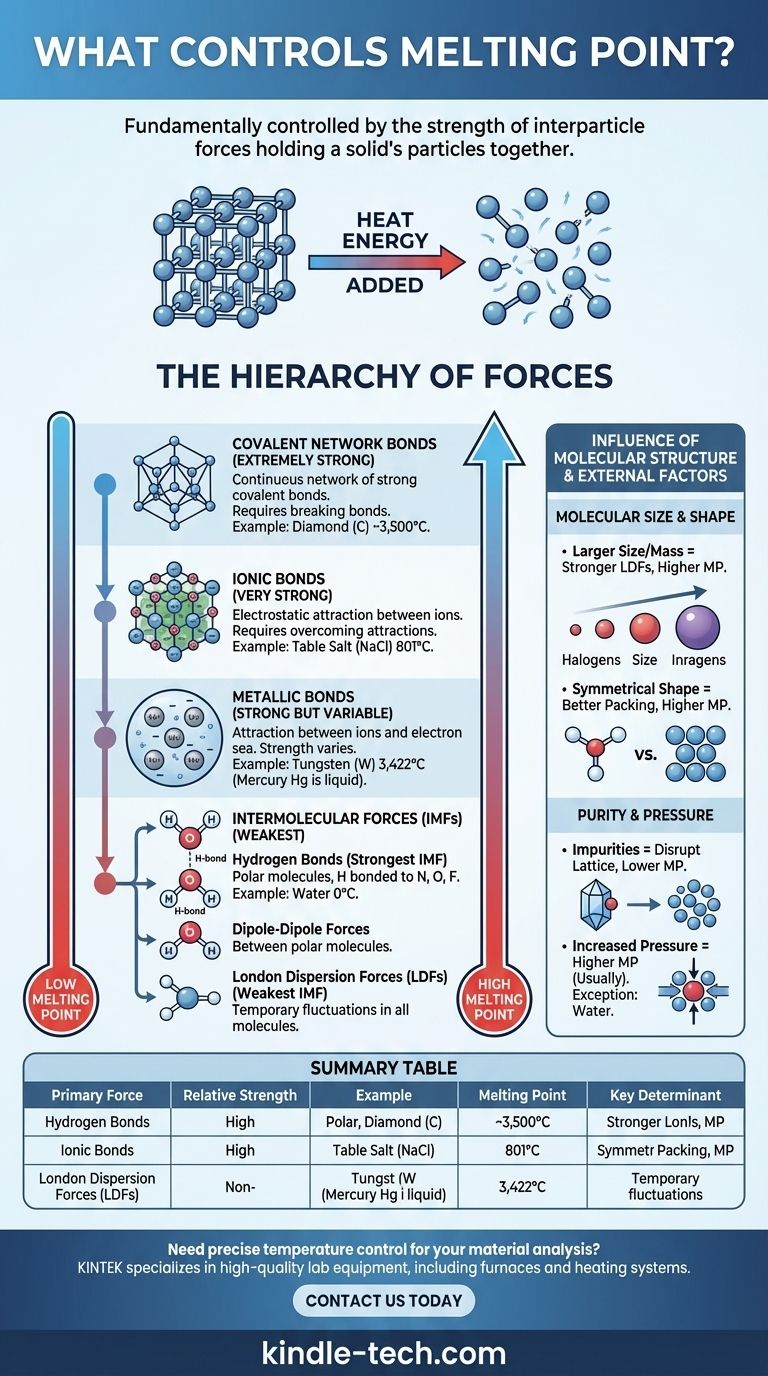
物質の融点は、その粒子を結合させている力の強さによって根本的に制御されます。 固体中では、粒子(原子、イオン、または分子)は結晶格子と呼ばれる固定された整然とした配置に固定されています。固体が融解するためには、これらの粒子がそれらの力を克服し、液体として互いに移動できるようにするのに十分な熱エネルギーを加える必要があります。したがって、より強い力は破壊するのにより多くのエネルギーを必要とし、その結果、融点が高くなります。
基本的な原理は単純です。融解とは、粒子そのものを破壊することではなく、粒子間の引力を克服することです。これらの粒子間力(強力なイオン結合から弱い分子間引力まで)の種類と強さが、物質の融点を決定する主要な要因となります。

力の階層
水素の-259°Cからタングステンの3,422°Cまでの融点の途方もないばらつきは、固体を結合させている力を分類することによって理解できます。これらの力は、強さの明確な階層構造を持っています。
イオン結合(非常に強い)
食塩(NaCl)のようなイオン化合物では、粒子は正と負に帯電したイオンです。これらは、強固な結晶格子内の強力な静電引力によって結合されています。
これらの強いイオン結合を克服するには、膨大な量の熱エネルギーが必要です。その結果、イオン化合物は一貫して非常に高い融点を示します。
共有結合性ネットワーク結合(極めて強い)
共有結合性ネットワーク固体では、原子は強固な共有結合の広大な連続ネットワークによって結合されています。個々の分子はなく、結晶全体が本質的に一つの巨大な分子です。
ダイヤモンド(炭素)や石英(二酸化ケイ素)などの物質がその典型例です。これらを融解させるには、これらの極めて強い共有結合を破壊する必要があり、莫大なエネルギーを必要とし、例外的に高い融点につながります。
金属結合(強いが変動的)
金属は、構造全体を自由に移動する非局在化電子の「海」の中に存在する正の金属イオンの格子で構成されています。正のイオンとこの電子の海との間の引力が金属結合を構成します。
この結合の強さ、ひいては融点は大きく異なります。これは、イオンの電荷や非局在化電子の数などの要因に依存します。これが、水銀が室温で液体であるのに対し、タングステンが全元素の中で最も高い融点の一つを持つ理由です。
分子間力(最も弱い)
分子性化合物(水、砂糖、ワックスなど)の場合、融解のために克服しなければならない力は分子間力(IMF)、つまり個々の分子間の引力です。これらは、上記で議論されたイオン結合、共有結合、または金属結合よりも著しく弱いです。
IMFには主に3つの種類があります。
- 水素結合: 最も強い種類のIMF。水素が電気陰性度の高い原子(窒素、酸素、またはフッ素)に直接結合している極性分子で発生します。水の比較的高い融点(0°C)は、これらの強い水素結合によるものです。
- 双極子-双極子力: 永久的な正極と負極を持つ極性分子間に発生します。これらの力は水素結合よりも弱いです。
- ロンドン分散力(LDF): 最も弱いIMFであり、すべての分子に存在します。これらは電子分布における一時的でランダムな変動から生じます。個々には弱いですが、累積効果はより大きな分子では無視できないものになることがあります。
分子構造の影響
力の種類に加えて、特に分子性化合物の場合、粒子固有のサイズと形状が重要な役割を果たします。
分子のサイズと質量
同じ主要な分子間力(例:LDF)を持つ化合物のうち、分子が大きいほど融点が高くなります。これは、大きな分子はより多くの電子を持ち、より強いロンドン分散力を生み出す、より「分極しやすい」電子雲を形成するためです。この傾向はハロゲンで明らかです。フッ素(F₂)からヨウ素(I₂)に向かうにつれて融点は上昇します。
分子の形状と充填効率
分子が結晶格子にどれだけ密接かつ効率的に充填できるかは大きな影響を与えます。対称性の高い分子は、同じ化学式と質量を持つ非対称な異性体よりも高い融点を持つことがよくあります。
対称的な形状により、分子は固体状態でより密接に結合でき、分子間力を最大限に効果的に発揮できます。このよく組織化された構造を破壊するには、より多くのエネルギーが必要です。
トレードオフとニュアンスの理解
融点を予測するには、これらの相互に関連する要因を比較検討する必要があります。
純度がすべてを変える
上記の原理は純粋な物質を前提としています。不純物は秩序だった結晶格子を乱し、全体の構造を弱めます。
この乱れにより、固体は融解しやすくなります。その結果、不純物を含む物質は、純粋な物質よりも低い温度で、より広い範囲で融解します。この現象は融点降下として知られています。
圧力も役割を果たす
融点は通常、標準大気圧で示されます。ほとんどの物質では、圧力を上げると融点が上昇します。なぜなら、圧力は粒子を物理的により密接に押し付け、格子構造を強化するからです。
水はこの点で有名で重要な例外です。固体氷は液体水よりも密度が低いため、圧力が増加するとより密度の高い液体相が優先され、それによって融点が低下します。
分析への適用方法
物質を比較する際は、体系的なアプローチを使用して、働いている主要な要因を特定します。
- 異なる種類の固体の比較に重点を置く場合: まず、主要な結合力(イオン性、共有結合性ネットワーク、金属性、または分子間力)を特定します。これが融点の相対的な最も重要な指標となります。
- 2つの分子性化合物の比較に重点を置く場合: それぞれが持つ最も強い分子間力(水素結合 > 双極子-双極子 > LDF)を決定します。より強いIMFを持つ化合物の方が、一般的に融点が高くなります。
- 類似した無極性分子の比較に重点を置く場合: 質量と表面積が大きい分子の方が、より強いロンドン分散力を持ち、したがって融点が高くなります。
- 異性体(同じ化学式、異なる形状)の比較に重点を置く場合: 結晶格子により効率的に充填できる、より対称的な分子の方が、しばしば融点が高くなります。
この力の階層と構造の影響を理解することで、ほぼすべての物質の融解挙動を体系的に説明することができます。
要約表:
| 主要な力の種類 | 相対的な強さ | 例となる物質 | 融点 | 主な決定要因 |
|---|---|---|---|---|
| 共有結合性ネットワーク | 極めて強い | ダイヤモンド (C) | 約3,500°C | 連続した格子内の共有結合の破壊 |
| イオン結合 | 非常に強い | 塩化ナトリウム (NaCl) | 801°C | イオン間の静電引力の克服 |
| 金属結合 | 強い(変動的) | タングステン (W) | 3,422°C | イオン-電子の海との引力の強さ |
| 分子間力 | 最も弱い | 水 (H₂O) | 0°C | 水素結合、双極子-双極子力、ロンドン分散力 |
材料分析のために正確な温度制御が必要ですか? 融点を理解することは、信頼できる実験結果を得るために不可欠です。KINTEKでは、正確な熱分析のために設計された炉や加熱システムを含む高品質の実験装置を専門としています。高融点の金属を扱う場合でも、感度の高い分子化合物を扱う場合でも、当社のソリューションは一貫した性能を保証します。当社の製品がお客様の研究室の能力をどのように向上させ、研究をサポートできるかについてご相談ください。今すぐお問い合わせください。開始するには、当社の問い合わせフォームからご連絡ください。
ビジュアルガイド
関連製品
よくある質問
- 蒸発にウォーターバスが使われる理由とは?効率的で安全な溶媒除去のために
- 高出力マグネチックスターラーは、灌漑用水の電気分解効率をどのように向上させますか?渦混合を強化しましょう。
- バイオマスの用途とは?多用途な再生可能エネルギー利用ガイド
- SEMにスパッタコーターを使用する理由とは?帯電防止と画質向上
- 機械的攪拌装置は、ドープされた酸化物コーティングの均一性にどのように貢献しますか?PEO触媒品質の向上
- 多孔質MAX相セラミックスのポリマーフォームテンプレートに必要な要件は何ですか?構造的完全性を確保する
- 電子顕微鏡におけるスパッタコーティングとは?鮮明なSEMイメージングのための必須の前処理
- CBDオイルはどのように蒸留されるのか?純度と効能を高めるためのステップバイステップガイド



















