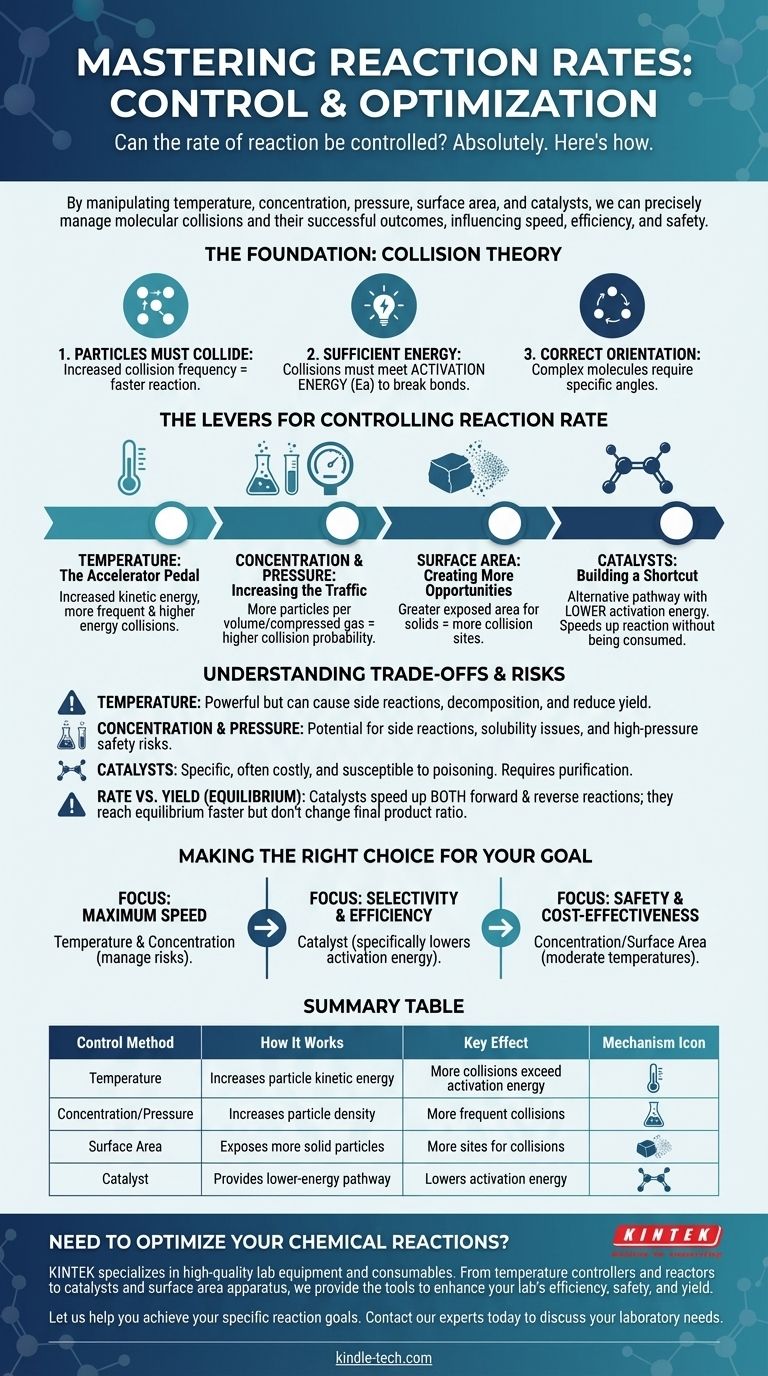
もちろんです。 化学反応の速度は固定された特性ではなく、正確に制御できます。特定の物理的および化学的要因を操作することにより、反応を意図的に加速、減速、さらには停止させることができます。この制御の主要な手段は、温度、反応物の濃度、圧力(気体の場合)、表面積(固体の場合)、および触媒の導入です。
反応速度の制御とは、本質的に分子衝突の頻度とエネルギーを管理することです。加熱から触媒の添加まで、すべての方法は、粒子の衝突頻度と、それらの衝突が成功するかどうかに影響を与えることによって機能します。
基礎:衝突理論
反応を制御するには、まず反応が起こる理由を理解する必要があります。あらゆる反応の速度は衝突理論の原理によって支配されており、反応が起こるためには3つの条件が満たされなければならないとされています。
1. 粒子は衝突しなければならない
2つ以上の分子が反応するためには、まず物理的に接触する必要があります。粒子の衝突頻度が高いほど、反応する機会が増え、反応速度が向上します。
2. 衝突には十分なエネルギーが必要
単に衝突するだけでは不十分です。衝突する粒子は、活性化エネルギー(Ea)として知られる最小限の運動エネルギーを持っている必要があります。このエネルギーは、新しい結合を形成できるように、既存の化学結合を切断するために必要です。
活性化エネルギーよりもエネルギーの低い衝突は失敗します。粒子は単に変化せずに跳ね返るだけです。
3. 粒子は正しい配向でなければならない
複雑な分子の場合、衝突は特定の角度または配向で起こらなければなりません。衝突時に分子の反応部位が適切に整列しない場合、エネルギー要件が満たされていても反応は起こりません。

反応速度を制御するための手段
衝突理論を理解することで、反応速度を操作するための明確なロードマップが得られます。各制御方法は、成功する衝突に必要な1つ以上の条件を変更することによって機能します。
温度:アクセルペダル
温度を上げると、粒子の平均運動エネルギーが上昇します。これには強力で二重の効果があります。
第一に、粒子がより速く移動し、衝突頻度が増加します。第二に、そしてより重要なことに、それらの衝突のうち、はるかに大きな割合が活性化エネルギーに等しいかそれ以上のエネルギーを持つようになり、成功する反応の速度が劇的に増加します。
濃度と圧力:交通量の増加
溶液中の反応物の濃度を上げると、同じ体積内に詰め込まれる粒子の数が増えます。これにより衝突の確率が直接的に増加し、反応速度が上昇します。
気体の場合、圧力を上げることは同じ効果をもたらします。気体分子を互いに近づけることで、実質的に濃度を高め、より頻繁な衝突につながります。
表面積:より多くの機会の創出
この要因は、固体が液体または気体と反応する場合に重要です。固体(例:塊から粉末へ)をより小さな断片に砕くことで、その総表面積が劇的に増加します。
これにより、固体のより多くの粒子が他の反応物にさらされ、衝突が発生するサイトがはるかに多くなり、全体の反応速度が増加します。
触媒:近道の構築
触媒とは、プロセスで消費されることなく反応速度を向上させる物質です。これは、より低い活性化エネルギーを持つ代替反応経路を提供することによって機能します。
触媒は、粒子の衝突頻度やエネルギーを上げるわけではありません。代わりに、成功するために衝突が乗り越えなければならないエネルギーの「障壁」を下げ、反応が進行しやすくします。
トレードオフとリスクの理解
これらの手段は効果的ですが、欠点がないわけではありません。適切な方法を選択するには、それらの限界と潜在的な欠点を理解する必要があります。
温度の鈍い力
熱は強力ですが、無差別なツールです。望ましい反応を加速しますが、潜在的な副反応も加速します。非常に高温では、反応物や生成物が分解し、全体の収率が低下することさえあります。
濃度と圧力の危険性
高濃度は、望ましくない副反応や溶解度の問題を引き起こすことがあります。さらに重要なことに、非常に高圧で操作するには、封じ込め失敗の可能性という重大な安全リスクを管理するために、特別で高価で堅牢な設備が必要です。
触媒の特異性とコスト
触媒はしばしば非常に特異的であり、非常に高価であることがあります(例:白金やパラジウムを使用するもの)。また、不純物によって使用不能になる可能性があり、これは触媒毒性として知られるプロセスであり、反応物の慎重な精製が必要です。
速度 対 収率(平衡)
反応速度と反応収率を区別することが重要です。順方向と逆方向の両方に進行できる可逆反応では、触媒は両方の反応を等しく加速します。これは、平衡に達する速度は速くなりますが、生成物と反応物の最終的な比率は変化しないことを意味します。
目標に合わせた適切な選択
反応を制御するための最適な戦略は、スピード、効率、安全性など、特定の目的に完全に依存します。
- 主な焦点が最大の速度である場合: 温度と濃度の増加が最も直接的なツールですが、副反応や安全上の危険性のリスクを積極的に管理する必要があります。
- 主な焦点が選択性と効率である場合: 触媒は、望ましい反応の活性化エネルギーを選択的に下げるため、他の反応を促進することなく、しばしば最良の選択となります。
- 主な焦点が安全性とコスト効率である場合: 中程度の温度での濃度または表面積の操作は、最もアクセスしやすく、リスクの低い方法であることがよくあります。
これらの要因を習得することで、化学反応を固定された事象から、特定の成果を達成するために正確に方向付けることができる動的なプロセスへと変えることができます。
要約表:
| 制御方法 | 作用機序 | 主な効果 |
|---|---|---|
| 温度 | 粒子の運動エネルギーを増加させる | より多くの衝突が活性化エネルギーを超える |
| 濃度/圧力 | 粒子の密度を増加させる | より頻繁な衝突 |
| 表面積 | より多くの固体反応物粒子を露出させる | より多くの衝突サイト |
| 触媒 | より低いエネルギーの反応経路を提供する | 活性化エネルギーを下げる |
化学反応の最適化が必要ですか?
反応速度を正確に制御することは、実験室での作業を成功させる鍵です。合成を加速する必要がある場合でも、選択性を向上させる必要がある場合でも、安全な操作を確保する必要がある場合でも、適切な機器が不可欠です。
KINTEKは、高品質の実験室機器と消耗品を提供することに特化しており、これらの変数を習得するのに役立ちます。熱と圧力を管理するための精密温度コントローラーや反応器から、最適な表面積相互作用のために設計された幅広い触媒や装置まで、当社の製品は実験室の効率、安全性、収率を高めるためのツールを提供します。
お客様の特定の反応目標達成を支援させてください。 今すぐ専門家にお問い合わせいただき、お客様の実験室のニーズについてご相談の上、最適なソリューションを見つけてください。
ビジュアルガイド
関連製品
- 高度な科学および産業用途向けのカスタマイズ可能な高圧反応器
- 多様な科学的用途に対応するカスタマイズ可能な実験室用高温高圧リアクター
- 実験用ミニSS高圧オートクレーブ反応器
- 熱水合成用高圧実験室オートクレーブ反応器
- 高温高圧用途向け温間静水圧プレス WIP ワークステーション 300MPa



















