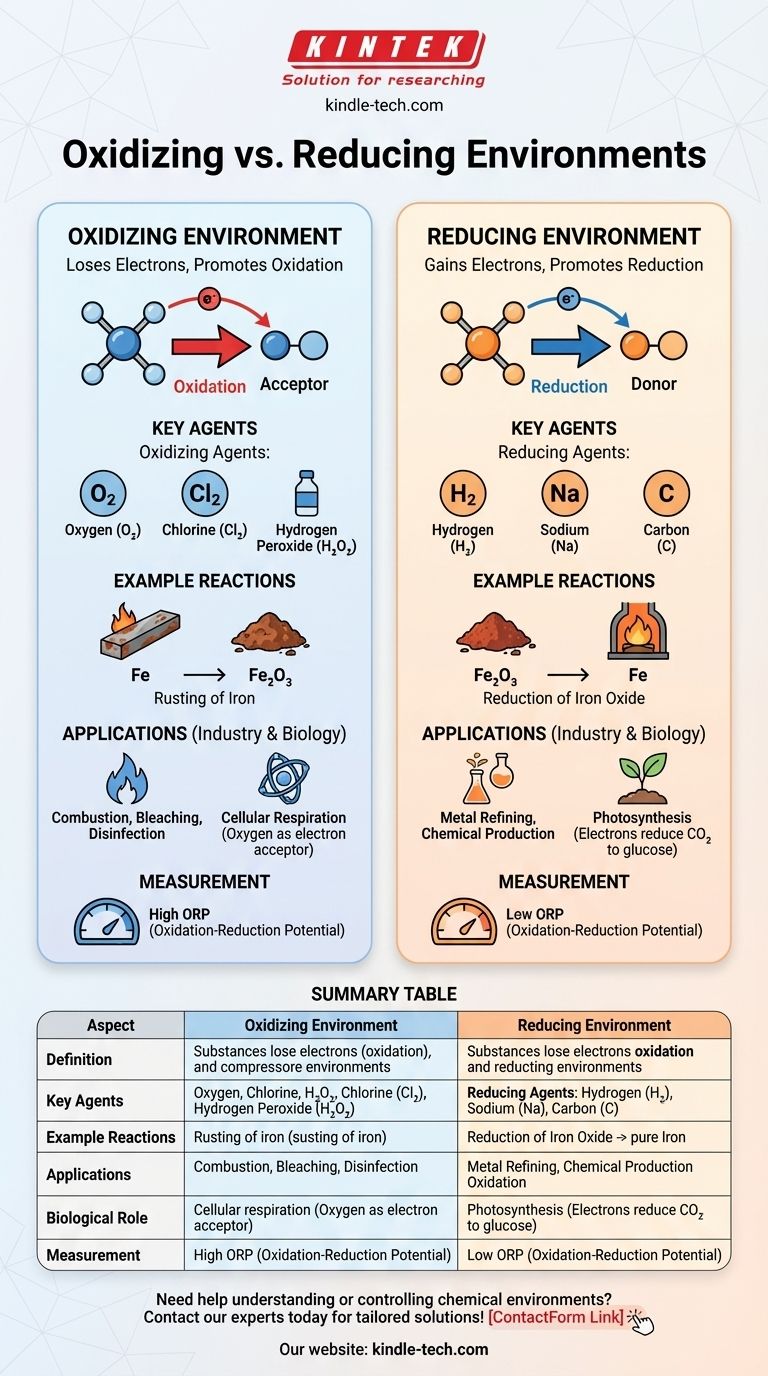
化学において、酸化環境とは物質が電子を失いやすく、酸化反応を促進する環境であり、還元環境とは物質が電子を得やすく、還元反応を促進する環境です。主な違いは、電子受容体(酸化剤)または電子供与体(還元剤)の利用可能性にあります。酸化環境は、酸素やハロゲンなどの酸化剤の存在によって特徴付けられ、電子の損失を促進します。対照的に、還元環境には、水素や金属などの還元剤が含まれており、電子の獲得を促進します。これらの環境は、化学反応、工業プロセス、および生物学的システムにおいて重要な役割を果たします。
主要なポイントの説明:
-
酸化環境と還元環境の定義:
- 酸化環境:物質が電子を失いやすく、酸化につながる化学環境。この環境は、酸素、塩素、その他の電子受容体などの酸化剤が豊富です。
- 還元環境:物質が電子を得やすく、還元につながる化学環境。この環境は、水素、金属、その他の電子供与体などの還元剤が豊富です。
-
酸化剤と還元剤の役割:
- 酸化剤:他の物質から電子を受け取り、それらを酸化する物質です。一般的な例には、酸素(O₂)、塩素(Cl₂)、過酸化水素(H₂O₂)などがあります。
- 還元剤:他の物質に電子を与え、それらを還元する物質です。一般的な例には、水素(H₂)、ナトリウム(Na)、炭素(C)などがあります。
-
異なる環境における化学反応:
- 酸化環境:このような環境では、酸化反応が優勢です。例えば、鉄の錆びは、鉄(Fe)が酸素に電子を失い、酸化鉄(Fe₂O₃)を形成する酸化環境で発生します。
- 還元環境:このような環境では、還元反応が優勢です。例えば、金属酸化物の純粋な金属への還元は、高炉で炭素が酸化鉄を鉄に還元するために使用される場合のように、還元環境で発生します。
-
産業と生物学における応用:
- 産業応用:酸化環境は、燃焼、漂白、消毒などのプロセスで使用されます。還元環境は、金属精錬や特定の化学物質の製造などのプロセスで重要です。
- 生物学的システム:生物学的システムでは、酸化環境は細胞呼吸のようなプロセスで見られ、酸素が最終的な電子受容体として機能します。還元環境は、光合成のようなプロセスで見られ、電子が二酸化炭素をグルコースに還元するために供与されます。
-
測定と制御:
- 酸化還元電位(ORP):ORPは、化学環境が電子を得るか失うかの傾向を測定するものです。高いORPは酸化環境を示し、低いORPは還元環境を示します。
- 工業プロセスにおける制御:産業においては、化学反応を最適化し、製品の品質を確保し、望ましくない副反応を防ぐために、環境の酸化性または還元性を制御することが重要です。
-
酸化環境と還元環境の例:
- 酸化環境:地球の大気は、酸素の存在により酸化環境です。これが、鉄のような金属が空気にさらされると腐食する理由です。
- 還元環境:高炉の内部は還元環境であり、一酸化炭素(CO)が還元剤として機能し、鉄鉱石(Fe₂O₃)を金属鉄(Fe)に変換します。
酸化環境と還元環境の違いを理解することで、化学者やエンジニアは、工業プロセスから生物学的システムまで、さまざまな応用における化学反応をより適切に制御し、最適化することができます。

要約表:
| 側面 | 酸化環境 | 還元環境 |
|---|---|---|
| 定義 | 酸素やハロゲンなどの電子受容体により、物質が電子を失う(酸化)環境。 | 水素や金属などの電子供与体により、物質が電子を得る(還元)環境。 |
| 主要な作用物質 | 酸化剤:酸素(O₂)、塩素(Cl₂)、過酸化水素(H₂O₂)。 | 還元剤:水素(H₂)、ナトリウム(Na)、炭素(C)。 |
| 反応例 | 鉄の錆び(Fe → Fe₂O₃)。 | 酸化鉄から鉄への還元(Fe₂O₃ → Fe)。 |
| 応用 | 燃焼、漂白、消毒。 | 金属精錬、化学物質の製造。 |
| 生物学的役割 | 細胞呼吸(酸素が電子受容体として機能)。 | 光合成(電子がCO₂をグルコースに還元)。 |
| 測定 | 高い酸化還元電位(ORP)。 | 低い酸化還元電位(ORP)。 |
化学環境の理解や制御でお困りですか?今すぐ専門家にお問い合わせください。お客様に合わせたソリューションをご提供します!
ビジュアルガイド
関連製品
- 制御窒素不活性水素雰囲気炉
- 伸線ダイス用ナノダイヤモンドコーティングHFCVD装置
- 顧客メイド多用途CVDチューブ炉 化学気相成長チャンバーシステム装置
- ラボスケール真空誘導溶解炉
- 黒鉛真空炉負極材黒鉛化炉
よくある質問
- タングステンアニーリングにおいて、水素還元雰囲気の維持が不可欠な理由は何ですか?高温処理における純度を確保する
- 高温腐食試験において、高純度アルゴンガスブランケットはどのような役割を果たしますか?正確なデータ精度を保証します。
- 水素アニーリングとは何ですか?優れた純度と磁気特性を引き出す
- ナノタングステン合成における管状雰囲気炉の具体的な機能は何ですか?粉末製造を最適化する
- パイロリス中に不活性窒素雰囲気の維持が必要なのはなぜですか?ナノコンポジット合成を保護する
- なぜアルゴンは窒素よりも優れているのでしょうか?溶接と断熱で優れた性能を実現
- ろう付けに窒素を使用できますか?主要な条件と用途を解説
- 還元性雰囲気とは何ですか? 酸化を制御し、特定の化学反応を達成する












