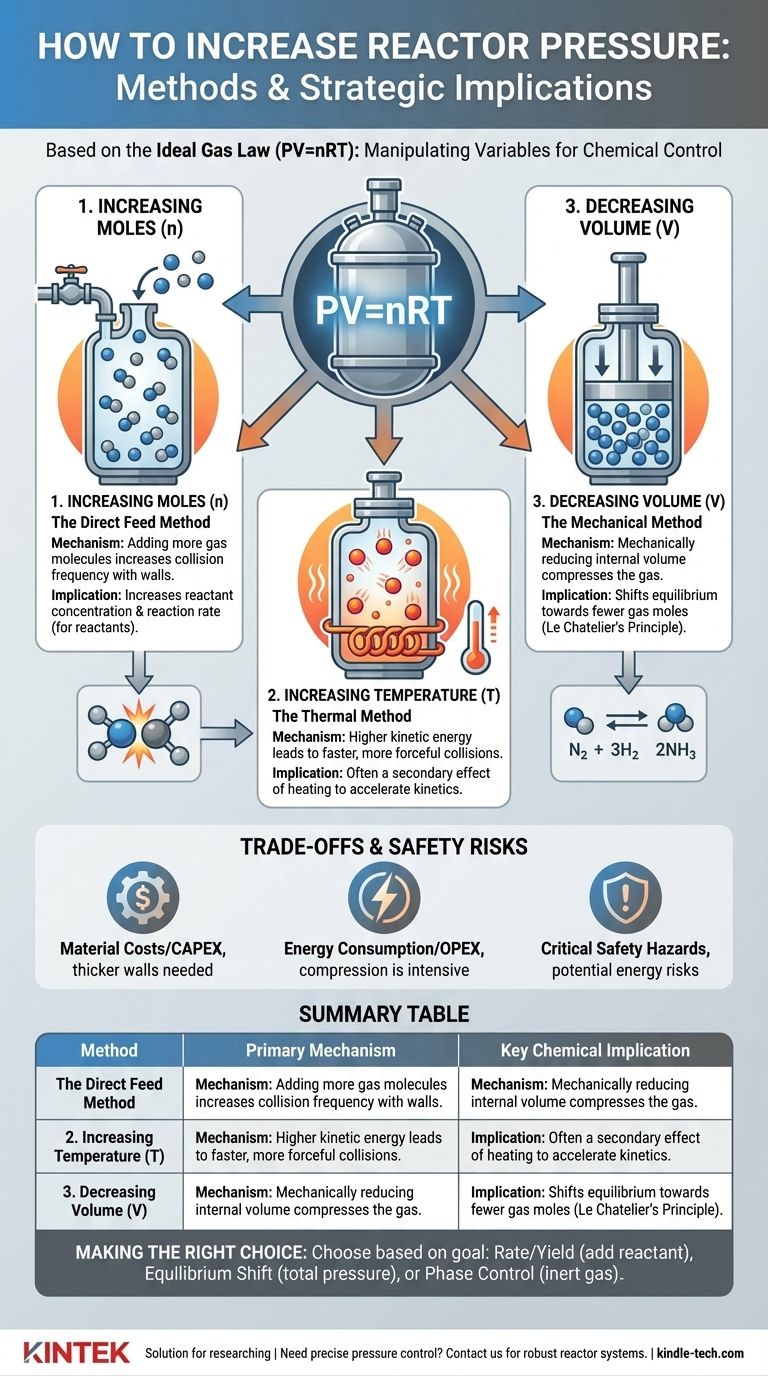
化学工学において、反応器の圧力を高めることは、基本的に理想気体の法則(PV=nRT)の変数を操作することによって達成されます。最も一般的な方法は、より多くの物質(ガス)を導入すること、系の温度を上げること、または反応器の体積を機械的に減らすことです。各方法は特定の目的を果たし、反応の速度論、平衡、および全体的な安全性に重要な影響を及ぼします。
中心的な課題は、単に圧力を「どのように」高めるかではなく、「なぜ」高めるのかということです。適切な方法の選択は、反応物濃度を高めること、化学平衡を移動させること、または反応器内の物質の相を制御することのいずれが目標であるかに完全に依存します。
圧力発生の基本原理
核となるのは、圧力はガス分子が容器の壁に衝突した結果であるということです。この圧力を高めるには、それらの衝突をより頻繁に、またはより強力にする必要があります。理想気体の法則は、これがどのように行われるかについての理論的枠組みを提供します。
モル数(n)の増加:直接供給法
これは最も簡単なアプローチです。固定された体積により多くのガス分子を追加することで、反応器の壁への衝突回数が増加し、それによって圧力が上昇します。
ただし、反応物を追加する場合と不活性ガスを追加する場合との間には重要な違いがあります。気体反応物の量を増やすと、その分圧が増加し、濃度が直接的に高まり、反応速度を加速させることができます。
逆に、不活性ガス(窒素やアルゴンなど)を追加すると、系の全圧は上昇しますが、反応物の分圧は変化しません。この手法は、反応速度に直接影響を与えるためではなく、相挙動の制御や熱管理のためによく使用されます。
温度(T)の増加:熱的方法
密閉された反応器を加熱すると、内部のガス分子の運動エネルギーが増加します。これらのエネルギーを与えられた分子はより速く移動し、反応器の壁への衝突がより頻繁かつ強力になり、これが圧力の上昇として現れます。
この方法は、反応速度を上げるために反応をより高い温度で実行した結果として二次的に生じることがよくあります。圧力の上昇は、反応器の設計の一部として予測し、管理する必要があります。
体積(V)の減少:機械的方法
特定のタイプの反応器では、内部体積を機械的に減らすことによって圧力を高めることができます。シリンダー内のピストンがガスを圧縮する様子を想像してください。
この方法は、大規模な連続反応器ではあまり一般的ではありませんが、特定の実験室でのセットアップ、バッチプロセス、および特定の種類の圧縮機やエンジンの主要な原理です。

高圧が化学に与える影響
圧力を高めることは、化学反応の結果に影響を与え、制御するために使用される強力なツールです。それは単なる物理的パラメータではなく、化学的挙動の主要な推進力です。
反応速度への影響
ほとんどの気相反応では、反応物の量を増やすことによって圧力を高めると、分子同士がより接近します。この高い濃度は分子衝突の頻度を増加させ、一般的に反応速度の加速につながります。
平衡への影響
これはルシャトリエの原理によって支配されます。可逆反応において、反応物側と生成物側で気体モル数が異なる場合、圧力を変えると平衡が移動します。
圧力を高めると、気体モル数が少ない反応側が優先されます。典型的な例は、アンモニア合成のためのハーバー・ボッシュ法(N₂ + 3H₂ ⇌ 2NH₃)であり、生成物であるアンモニア側に平衡を移動させるために高圧が使用されます。
相挙動への影響
圧力は、物質の物理的状態を制御するための重要なツールでもあります。高圧は、高温であっても液体が沸騰するのを防ぐことができ、これは多くの液相反応にとって不可欠です。また、分離のためにガスを液化したり、気液界面で起こる反応を促進したりするためにも使用できます。
トレードオフと安全上のリスクの理解
高圧はプロセス上の大きな利点をもたらす可能性がありますが、慎重に管理しなければならない重大なコストと危険が伴います。
材料および建設コスト
高圧反応器は、封じ込めを確実にするために、より厚い鋼壁、より高度な合金、および非常に特殊なシールと継手を必要とします。これにより、プロジェクトの初期設備投資(CAPEX)が劇的に増加します。
エネルギー消費
ガスを高圧に圧縮するプロセスは、非常にエネルギー集約的です。これは継続的な運用支出(OPEX)の増加に直接つながり、プロセスの経済的実行可能性に大きな影響を与える可能性があります。
重大な安全上の危険
最も重要な考慮事項は安全性です。高圧システムは膨大な量のポテンシャルエネルギーを蓄えています。破裂や故障は、壊滅的な爆発的放出につながる可能性があります。
すべての高圧システムには、これらのリスクを軽減するために、圧力逃がし弁、破裂板、および厳格な検査・保守プロトコルを含む複数の安全層が装備されていなければなりません。
目標に応じた適切な選択
圧力を高めるための正しい方法は、化学プロセスの特定の目的にによって決まります。
- 反応速度と収率の向上を主な目的とする場合: 気体反応物を直接追加することが最も効果的な戦略です。なぜなら、反応を促進する分圧が増加するからです。
- 化学平衡を移動させることを主な目的とする場合: 圧縮または反応物の追加による全システム圧力の増加は、生成物側に少ないモル数のガスがある反応にとって不可欠です。
- 通常の沸点以上に液体相を維持することを主な目的とする場合: 全圧力を高めること(しばしば不活性ガスを使用)が、必要なプロセス条件を作り出す鍵となります。
結局のところ、反応器の圧力を制御することは、望ましい結果を安全かつ効率的に達成するために、システムの熱力学と速度論を戦略的に操作することなのです。
要約表:
| 方法 | 主要なメカニズム | 主要な化学的影響 |
|---|---|---|
| モル数(n)の増加 | より多くのガス分子の追加 | 反応物濃度/反応速度の増加 |
| 温度(T)の増加 | 分子運動エネルギーの上昇 | 反応を加速するための加熱の二次的効果 |
| 体積(V)の減少 | ガスの機械的圧縮 | 気体モル数が少ない方向への平衡の移動 |
実験室プロセスで正確な圧力制御が必要ですか? KINTEKは、安全で効率的な圧力管理のために設計された堅牢な反応器システムを含む、高品質の実験装置および消耗品の専門メーカーです。当社のソリューションは、最適な反応速度論、収率、および安全性の達成を支援します。 KINTEKに今すぐお問い合わせいただき、お客様の実験室の特定のニーズをどのようにサポートできるかご相談ください。
ビジュアルガイド
関連製品
- 多様な科学的用途に対応するカスタマイズ可能な実験室用高温高圧リアクター
- 高度な科学および産業用途向けのカスタマイズ可能な高圧反応器
- 実験室用高圧水平オートクレーブ蒸気滅菌器
- 熱水合成用高圧実験室オートクレーブ反応器
- ラボ用高圧蒸気滅菌器 縦型オートクレーブ



















