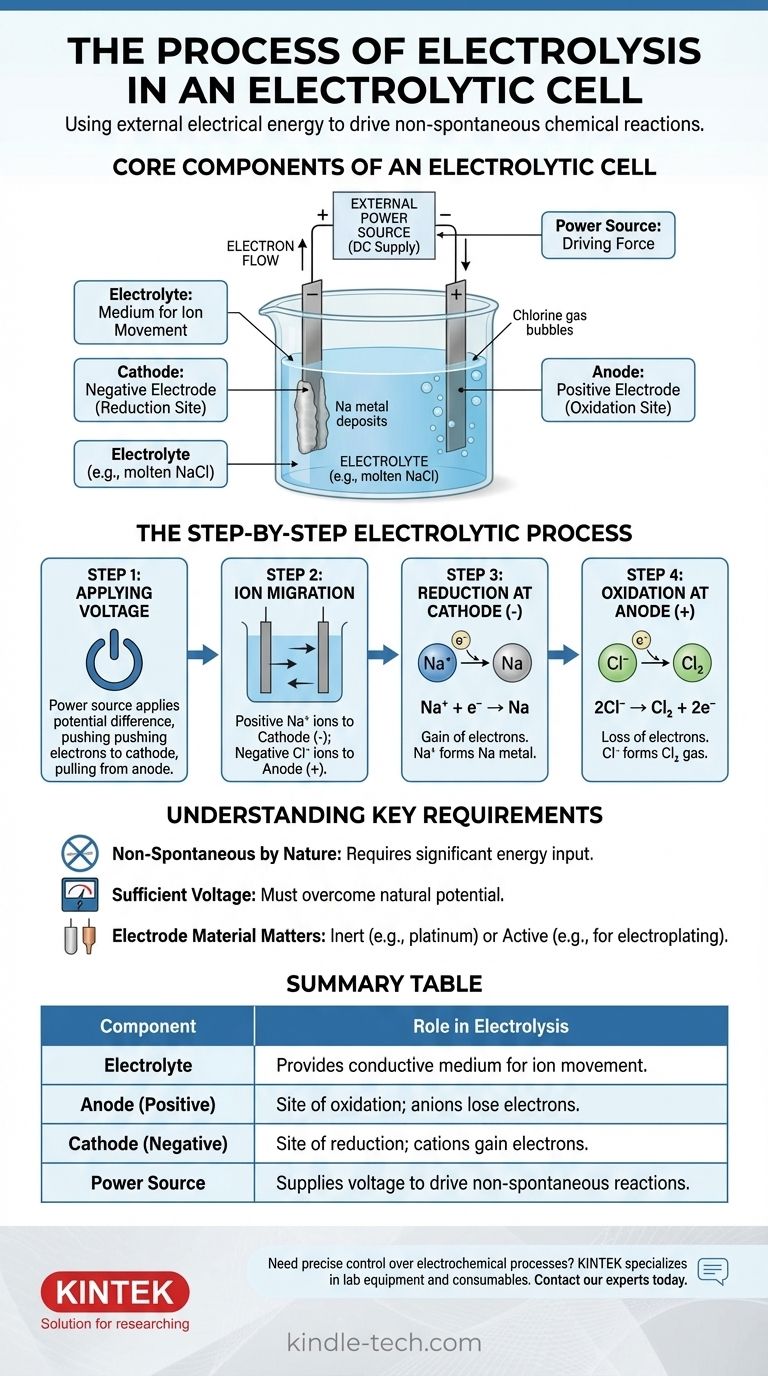
本質的に、電気分解とは、それ自体では起こらない化学反応を電気エネルギーを使って進行させるプロセスです。外部電源が、電解質と呼ばれる導電性の溶液または溶融塩に浸された2つの電極に電圧を印加します。この印加されたエネルギーにより、イオンは反対に帯電した電極に移動し、そこで酸化還元反応を通じて分解されます。
電解槽は、化学反応を逆転させるためのエンジンです。外部電源を印加することで、電子を自然な傾向に逆らって流し、安定した化学化合物を構成元素に分解させます。
電解槽の主要構成要素
プロセスを理解するには、まず各部分の機能を理解する必要があります。このシステムは、3つの主要な構成要素間の綿密に調整された相互作用です。
電解質:イオン移動の媒体
電解質は、自由に移動するイオンを含む物質であり、これにより導電性を持っています。通常、塩化ナトリウム(NaCl)のような溶融イオン化合物、または溶解したイオンを含む水溶液です。
電解質の唯一の目的は、帯電したイオンが電極間を移動できる媒体を提供することです。
電極:陽極と陰極
電極は、電解質に浸された導電性材料(多くの場合、金属またはグラファイト)です。これらは、電気回路が化学溶液と接する物理的な界面として機能します。
電解槽では、極性は外部電源によって定義されます。
- 陽極は正の電極です。
- 陰極は負の電極です。
外部電源:駆動力
これは通常、バッテリーまたはDC電源です。その役割は、電極間に電位差を作り出し、電子を自発的には移動しない方向に強制的に移動させることです。
この外部電圧は、電解質の自然な化学的安定性を克服し、非自発的な反応全体を駆動する「ポンプ」です。

ステップバイステップの電気分解プロセス
電源が作動すると、プロセスは正確な順序で展開されます。溶融塩化ナトリウム(NaCl)の例を使用してこれを説明できます。
ステップ1:電圧の印加
外部電圧が印加されます。電源は電子を一方の電極に押し込み、それを負に帯電させ(陰極)、もう一方の電極から電子を引き離し、それを正に帯電させます(陽極)。
ステップ2:イオン移動
溶融NaCl電解質中では、ナトリウムは陽イオン(カチオン、Na⁺)として存在し、塩化物は陰イオン(アニオン、Cl⁻)として存在します。
異極は引き合います。正のNa⁺カチオンは負の陰極に引き寄せられ、負のCl⁻アニオンは正の陽極に引き寄せられます。
ステップ3:陰極(負の電極)での還元
Na⁺カチオンが負に帯電した陰極に到達すると、それぞれ電源から供給された電子を受け取ります。この電子の獲得は還元反応です。
Na⁺イオンは還元されて中性のナトリウム金属(Na)を形成し、陰極に析出します。
ステップ4:陽極(正の電極)での酸化
同時に、Cl⁻アニオンが正に帯電した陽極に到達すると、それぞれ電極に電子を与えます。この電子の喪失は酸化反応です。
Cl⁻イオンは酸化されて中性の塩素原子を形成し、これらが対になって塩素ガス(Cl₂)となり、陽極から泡立って放出されます。放出された電子は外部回路を通って電源に戻り、回路を完成させます。
主要な要件の理解
電気分解は強力ですが、特定の制約の下で動作します。これらを無視すると、実験の失敗や結果の誤解につながる可能性があります。
本質的に非自発的
中心原則は、電気分解が非自発的な反応を促進するということです。例えば、塩がナトリウム金属と塩素ガスに分解するには、かなりのエネルギー入力が必要です。外部電圧がなければ、何も起こりません。
十分な電圧の必要性
外部電源は、化学反応の自然な電位を克服するのに十分な高さの電圧を供給する必要があります。電圧が低すぎると、イオン移動と電子移動を強制するのに十分な強さがなく、反応は進行しません。
電極材料の重要性
単純な分解には、不活性電極(白金や炭素など)が使用されます。これらの材料は、反応自体に参加することなく電子移動を促進します。電気めっきのような他の用途では、陽極は酸化されて電解質に溶解するように設計された「活性」電極である場合があります。
一般的な例への適用
電気分解の原理は普遍的ですが、特定の生成物は使用される電解質に完全に依存します。
- 純粋な金属を製造する場合:その金属の溶融塩を電解質として使用します。純粋な金属は還元され、陰極に析出します。これはナトリウムやアルミニウムの工業生産で見られます。
- 水を分解する場合:導電性を向上させるために、少量の酸または塩を加えた水を使用します。このプロセスでは、陰極で水素ガス(H₂)、陽極で酸素ガス(O₂)が生成されます。
- 物体を電気めっきする場合:めっきされる物体を陰極に設定します。電解液中の金属イオンが物体の表面で還元され、薄く均一な金属コーティングを形成します。
電子の流れを制御することで、化学プロセスを直接制御し、逆転させることができます。これは現代産業の多くを支える基本的な能力です。
要約表:
| 構成要素 | 電気分解における役割 |
|---|---|
| 電解質 | イオン移動のための導電性媒体を提供(例:溶融NaCl)。 |
| 陽極(正) | 酸化の場。陰イオンが電子を失う(例:Cl⁻ → Cl₂ガス)。 |
| 陰極(負) | 還元の場。陽イオンが電子を得る(例:Na⁺ → Na金属)。 |
| 電源 | 非自発的な反応を促進するために電圧を供給。 |
電気化学プロセスを正確に制御する必要がありますか? KINTEKは、電気分解、電気めっき、材料合成のための実験装置と消耗品を専門としています。当社の信頼性の高い電源、電極、電解液は、化合物の分解、金属の精製、表面コーティングなど、一貫した結果を達成するのに役立ちます。今すぐ当社の専門家にお問い合わせください。お客様のラボの特定のニーズについてご相談ください!
ビジュアルガイド
関連製品
- 電気化学実験用石英電解電気化学セル
- H型二層式光学恒温槽電解セル
- 電解電気化学セル ガス拡散液体フロー反応セル
- NRR、ORR、CO2RR研究用のカスタマイズ可能なCO2削減フローセル
- リチウム空気電池用電池ケース(電池ラボ用途)



















