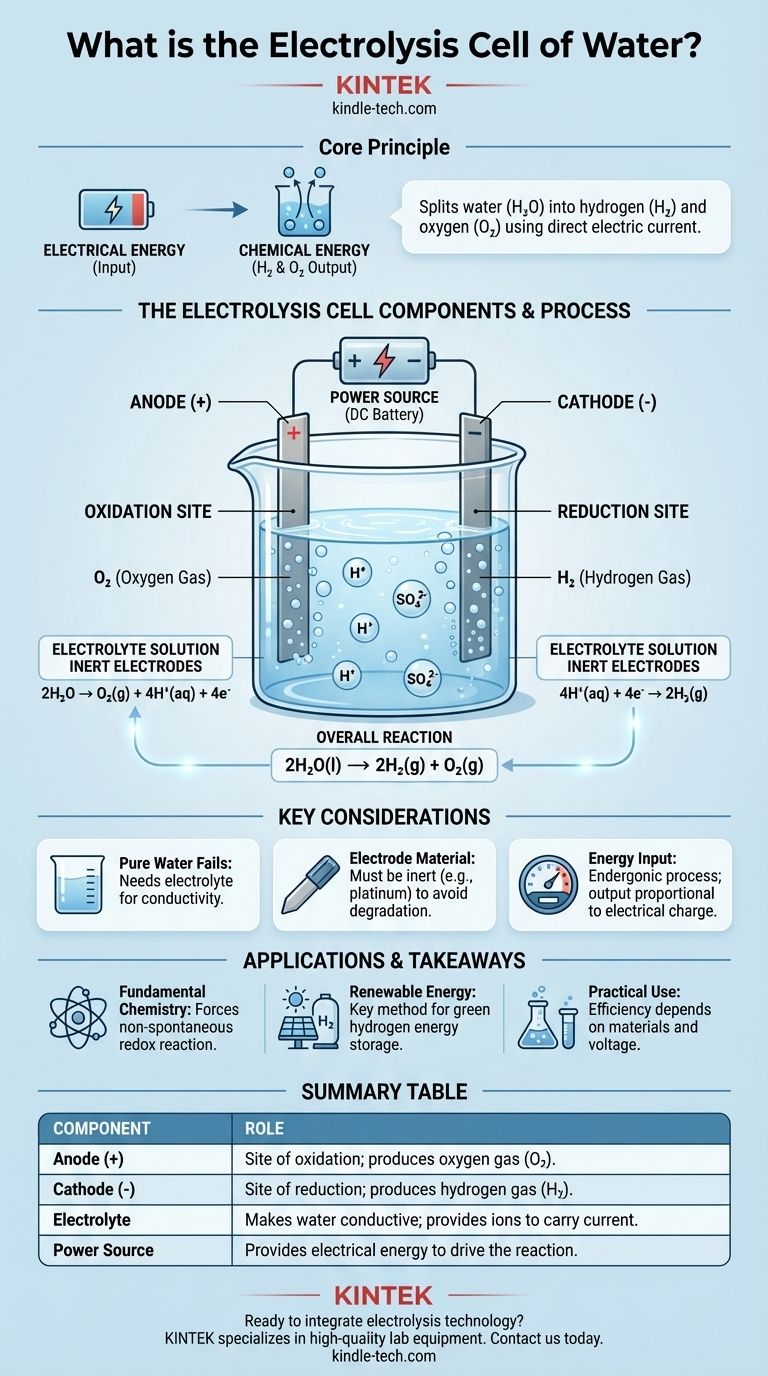
その核心において、水の電気分解セルは、電気エネルギーを使用して水(H₂O)をその構成要素である水素ガス(H₂)と酸素ガス(O₂)に分解する装置です。これは、少量の電解質を含む水に直流電流を流すことによって、自然には起こらない化学変化を強制的に引き起こすことで達成されます。基本的な構成要素は、電解質に浸され、外部電源に接続された2つの電極(陽極と陰極)です。
電気分解セルの中心的な目的は、電気エネルギーを化学エネルギーに変換することです。外部電圧を使用して非自発的な酸化還元反応を駆動し、入力されたエネルギーを生成される水素分子と酸素分子の化学結合に効果的に貯蔵します。
主要な構成要素とその役割
水の電解セルは、電極、電解質、電源という3つの主要な部分の正確な相互作用によって動作します。それぞれがプロセスにおいて明確で重要な役割を果たします。
電極:陽極と陰極
セルには2つの電極が含まれており、これらは電流が溶液に出入りするための導体です。これらは通常、反応によって消費されることなく反応を促進するように、不活性材料(白金やグラファイトなど)で作られています。
陽極は正極です。ここは酸化の場所であり、物質が電子を失います。
陰極は負極です。ここは還元の場所であり、物質が電子を獲得します。
電解質:水を導電性にする
純水は、電流を運ぶための自由移動イオンが非常に少ないため、電気の導体としては非常に劣っています。
これを解決するために、硫酸(H₂SO₄)などの少量の電解質が添加されます。電解質は水に溶解し、電極間で電荷を輸送できる移動性のイオン(この場合、H⁺とSO₄²⁻)を提供し、電気回路を完成させます。
電源:反応を駆動する
水の分解は吸エルゴン反応であり、反応が起こるためにはエネルギーの入力が必要です。水は安定しており、自発的に分解することはありません。
バッテリーやDC電源のような外部電源が、必要な電圧を供給します。この電気的圧力は、電子を陰極に「押し込み」、陽極から「引き抜き」、水の化学分解を強制的に進行させます。

化学プロセス:水がどのように分解されるか
全体的なプロセスは、各電極で起こる2つの異なる半反応に分けられる酸化還元反応です。
陽極(+)での酸化
正の陽極では、水分子が酸化されます。水分子は電子を放出し、その電子はセルから外部回路に流れ出します。
この反応は酸素ガス(O₂)と水素イオン(H⁺)を生成します。半反応は次のとおりです:2H₂O → O₂(g) + 4H⁺(aq) + 4e⁻
陰極(-)での還元
陽極で生成された水素イオン(H⁺)(および酸性電解質中に存在する水素イオン)は、負の陰極に引き寄せられます。
陰極では、これらのイオンは外部回路から流入する電子を獲得します。この還元反応は水素ガス(H₂)を生成します。半反応は次のとおりです:4H⁺(aq) + 4e⁻ → 2H₂(g)
全体反応
2つの半反応を組み合わせると、両側の電子と水素イオンが相殺され、水の電気分解のシンプルでエレガントな全体結果が明らかになります。
正味の化学変化は次のとおりです:2H₂O(l) → 2H₂(g) + O₂(g)。2分子の水が分解されるごとに、2分子の水素ガスと1分子の酸素ガスが生成されます。
重要な考慮事項を理解する
概念は単純ですが、セルが正しく効率的に機能するためにはいくつかの要因が重要です。これらの制限を理解することで、プロセスの真の性質が明らかになります。
純水が機能しない理由
電解質がないと、水の抵抗は非常に高くなります。電圧を印加しても電流の流れはごくわずかであり、したがって水素や酸素の生成はほとんどありません。電解質は消費されません。その唯一の役割は電荷キャリアとして機能することです。
電極材料は極めて重要
白金のような不活性電極を使用することが不可欠です。陽極に亜鉛や銅のような反応性金属を使用すると、水ではなく陽極自体が酸化されて溶液に溶解してしまいます。これにより、意図しない異なる生成物が生成され、電極が破壊されます。
エネルギー入力が生成物を決定する
電気分解は自由エネルギーの源ではありません。それはエネルギー変換プロセスです。生成される水素と酸素の量は、セルを通過する電荷の量に正比例します。少量の水素ガスを生成するには、かなりの量の電気エネルギーが必要です。
目標に合った適切な選択をする
電気分解セルを理解することは、いくつかの分野で価値があります。あなたの目的によって、得られる知識は異なります。
- 主要な焦点が基礎化学である場合:これは、電気エネルギーが非自発的な酸化還元反応を強制し、安定した化合物をその元素に分離する方法を完璧に示していると見てください。
- 主要な焦点が再生可能エネルギーである場合:電気分解を、太陽光や風力などの供給源からの余剰電力を水素燃料に変換するエネルギー貯蔵の主要な方法として認識してください。
- 主要な焦点が実用的な応用である場合:電気分解の効率、速度、および生成物は、使用される特定の材料(電解質、電極材料、印加電圧)に完全に依存することを忘れないでください。
最終的に、水の電気分解は、電気を使用して単純な分子内に貯蔵された化学エネルギーを引き出す強力なプロセスです。
要約表:
| 構成要素 | 電気分解セルにおける役割 |
|---|---|
| 陽極(正極) | 酸化の場所。酸素ガス(O₂)を生成します。 |
| 陰極(負極) | 還元の場所。水素ガス(H₂)を生成します。 |
| 電解質 | 水を導電性にし、電流を運ぶイオンを提供します。 |
| 電源 | 非自発的な反応を駆動するための電気エネルギーを供給します。 |
電気分解技術を研究室のワークフローに統合する準備はできていますか? KINTEKは、高度な化学プロセス向けの高品質な実験装置と消耗品を専門としています。新しいエネルギー貯蔵ソリューションの開発や基礎研究の実施に関わらず、当社の専門知識は、お客様が必要とする信頼性の高い装置を保証します。今すぐ当社のチームにご連絡ください。お客様の特定の研究室要件をどのようにサポートできるかについてご相談ください。
ビジュアルガイド
関連製品
よくある質問
- プロトン交換膜が汚染または損傷していることが判明した場合、どうすべきですか?性能回復か、安全のための交換か
- 実験中に電解セルをセットアップする手順は何ですか?正確な電気化学データのためのセットアップを習得する
- 3電極式電解セルシステムはどのように精度を確保しますか?アルミナ複合材の腐食試験を最適化する
- 電解セルを加熱または滅菌する際の注意点は何ですか?敏感な部品の損傷を避ける
- セル部品の耐熱限界はどこにありますか?実験室での壊滅的な故障を避ける
- 電気化学電池における腐食とは何か?金属劣化の4つの要素を理解する
- 5ポート水浴電解槽の事前準備手順は何ですか?信頼できる結果を得るための4ステップガイド
- シュウ酸溶液を電解研磨に使用する目的は何ですか? 金属組織の鮮明度を高める



















