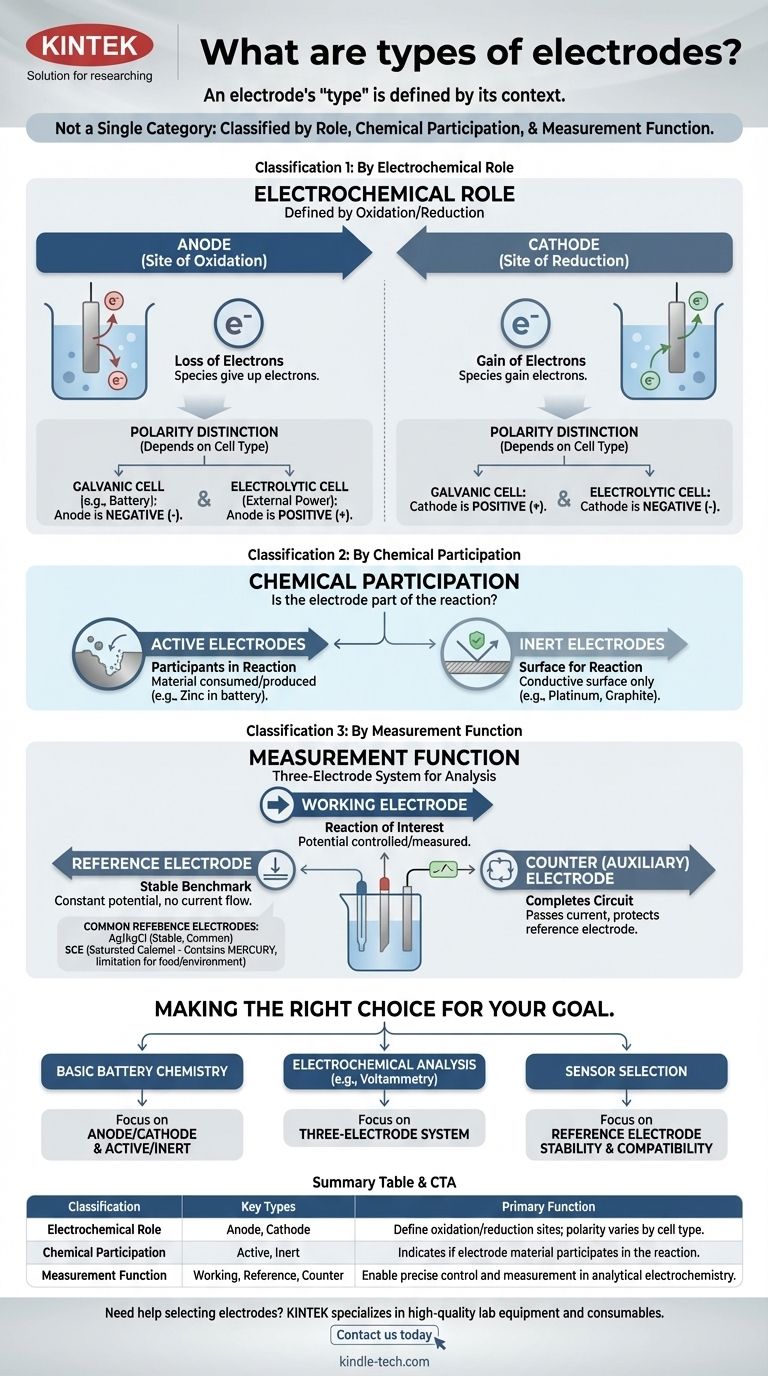
「電極」という用語は、単一のカテゴリではありません。むしろ、電極は、反応における役割、化学的関与、および測定システム内での機能に基づいて、いくつかの異なる方法で分類されます。これらの異なる分類システムを理解することが、あらゆる電気化学セルにおけるその目的を把握するための鍵となります。
最も重要な洞察は、電極の「タイプ」がその文脈によって定義されるということです。同じ金属片でも、それが置かれる電気化学システムによって、アノードにもカソードにも、活性にも不活性にもなり得ます。
分類1:電気化学的役割による分類
最も基本的な分類は、電気化学反応の2つの半分(酸化と還元)における電極の役割によって電極を定義します。
アノード:酸化の場
アノードは、定義上、酸化(電子の損失)が起こる電極です。アノードでは、種が電子を電極に与えます。
カソード:還元の場
カソードは、還元(電子の獲得)が起こる電極です。カソードは、溶液中の種に電子を与えます。
重要な区別:アノード/カソードの極性
よく混同される点として、アノードとカソードの電荷(+または-)があります。この極性はセルの種類によって異なります。
- ガルバニ電池(バッテリーなど)では、自発的な反応がエネルギーを生成します。アノードは負極、カソードは正極です。
- 電解槽では、外部電源が非自発的な反応を駆動します。アノードは正極、カソードは負極です。
分類2:化学的関与による分類
この分類は、電極材料自体が化学反応の一部であるかどうかを記述します。
活性電極:反応への参加者
活性電極は、セルの反応中に消費または生成される材料でできています。例えば、亜鉛-銅電池では、亜鉛アノードが溶解し、酸化半反応に積極的に関与します。
不活性電極:反応のための表面
不活性電極は、化学反応には関与しません。酸化または還元が起こり得る導電性表面としてのみ機能します。白金や炭素(グラファイト)は、ガスや溶解したイオンを含む反応を促進するために使用される一般的な不活性電極です。
分類3:測定機能による分類
分析電気化学では、精密な測定のために三電極システムがよく使用されます。これにより、機能的な分類が生じます。
作用電極
これは、目的の反応が起こっている電極です。その電位は、制御または測定される主要な変数です。
参照電極:安定したベンチマーク
参照電極は、作用電極の電位が測定される際の、安定した一定の電位を提供します。流れる電流やバルク溶液の組成に関わらず、それ自体の電位は変化しません。
対電極(または補助電極)
この電極の唯一の目的は、電気回路を完成させることです。作用電極に必要なすべての電流を流し、敏感な参照電極に流れる電流が無視できるほどであることを保証し、その安定性を保護します。
トレードオフの理解:一般的な参照電極
参照電極の選択は、正確な測定にとって非常に重要であり、化学環境に依存します。
Ag/AgCl:一般的な主力
銀/塩化銀(Ag/AgCl)電極は、最も一般的な参照電極です。安定しており、安価で、一般的に信頼性が高いため、多くの水溶液のデフォルトの選択肢となっています。
飽和カロメル電極(SCE):古典的な代替品
飽和カロメル電極(SCE)は、より古く、非常に安定した標準電極です。銀または塩化物イオンと適合しないサンプル溶液の場合など、Ag/AgCl電極と干渉する可能性のある状況でよく使用されます。
水銀の問題:主要な制限
SCEの主な欠点は、水銀を含んでいることです。このため、水銀汚染が重大な懸念事項となる食品、飲料、または環境試験を含む用途には不向きです。
目標に合った適切な選択をする
あなたのアプリケーションによって、どの分類が最も重要かが決まります。
- 基本的なバッテリー化学の理解が主な焦点である場合:アノード/カソードおよび活性/不活性電極の概念を習得してください。
- 電気化学分析(ボルタンメトリーなど)の実施が主な焦点である場合:三電極システム(作用、参照、対)が不可欠なフレームワークです。
- 特定の環境用のセンサーの選択が主な焦点である場合:主な関心事は、Ag/AgClと代替品との選択など、参照電極の化学的適合性と安定性になります。
これらの重複する分類を理解することで、あらゆる電気化学システムの挙動を制御し、解釈する力が得られます。

要約表:
| 分類 | 主要な種類 | 主な機能 |
|---|---|---|
| 電気化学的役割 | アノード、カソード | 酸化/還元の場所を定義。極性はセルタイプ(ガルバニ/電解)によって異なる |
| 化学的関与 | 活性、不活性 | 電極材料が反応に関与するか、単に表面として機能するかを示す |
| 測定機能 | 作用、参照、対 | 分析電気化学における精密な制御と測定を可能にする |
研究室の電気化学アプリケーションに最適な電極の選択でお困りですか? KINTEKでは、お客様の研究ニーズに合わせた高品質な実験装置と消耗品の提供を専門としています。バッテリー開発、センサー設計、分析測定のいずれに取り組んでいる場合でも、当社の専門知識により、精度と性能に最適な電極を確実に入手できます。今すぐお問い合わせいただき、お客様の要件について話し合い、電気化学ワークフローを強化しましょう!
ビジュアルガイド