電気化学セル入門
電気化学セル は、エネルギー貯蔵と変換の中核をなすものである。化学反応を利用して電気を発生させたり、電気を利用して化学反応を促進させたりする。これらのセルは、バッテリー、燃料電池、電気メッキを含む様々な電気化学システムに不可欠なコンポーネントであり、エネルギー技術、電気自動車、電気化学工学の進歩に不可欠である。
電気化学セルの種類
電気化学電池は、化学エネルギーを電気エネルギー(ボルタ電池)またはその逆(電解電池)に変換する装置である。電解質溶液に浸された陰極と陽極の2つの電極で構成される。
ボルタ電池
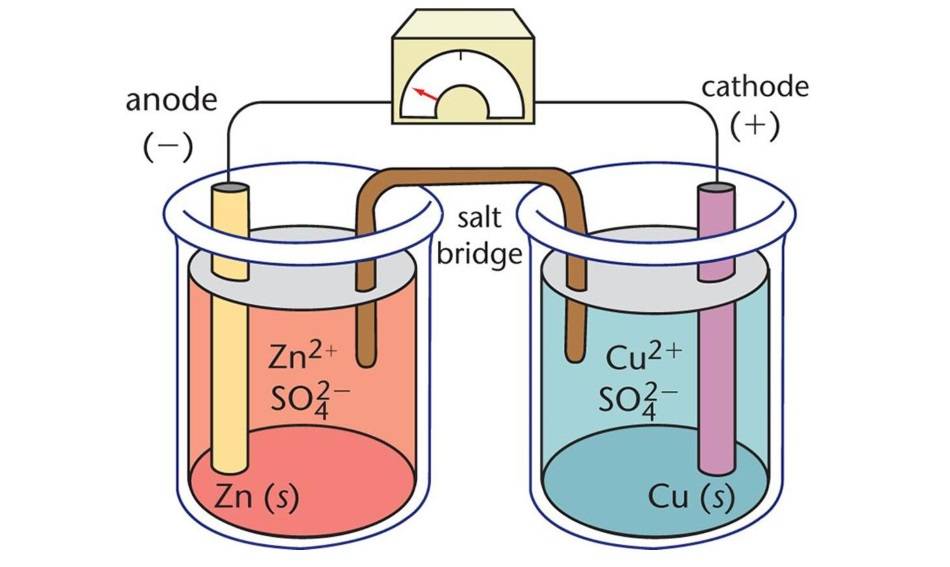
ガルバニ電池としても知られるボルタ電池は、自発的な化学反応から電気を発生させる。ボルタ電池では、負極は酸化が起こり電子が放出される電極である。これらの電子は外部回路を通って正極に流れ、正極では還元が起こる。反応の自発性により電子の流れが促進され、電流が発生する。
電解セル
一方、電解槽は電気を用いて非自発的な化学反応を駆動する。電解セルでは、正極は還元が起こる負極であり、負極は酸化が起こる正極である。外部電源は、非自発的な反応を強制的に進行させるのに必要な電気エネルギーを供給する。
主な違い
ボルタ電池と電解電池の主な違いは以下の通り:
- 自発性: 自発性:ボルタ電池は自発的な反応から電気を発生させるが、電解電池は非自発的な反応を促進するために外部エネルギーを必要とする。
- 電子の流れの方向: ボルタ電池では、電子は外部回路を通って陽極から陰極に流れる。電解セルでは、電子は外部回路を通って陰極から陽極に流れる。
- 応用例: ボルタ電池は、電池、太陽電池、その他の発電装置に使用される。電解セルは、電気メッキ、金属精錬、その他の工業プロセスで使用される。
電気化学セルの構成要素
電気化学セルは通常、以下の部品で構成されている:
- 電極: 陰極と陽極で、導電性材料(金属、グラファイトなど)でできている。
- 電解液: イオンを伝導する溶液または溶融塩で、電極間の電流の流れを可能にする。
- セパレーター: 電極が直接接触するのを防ぐが、イオンは通過させる多孔性のバリア。
その他の情報
- 電気化学セルのセル電位(電圧)は、反応の駆動力の尺度である。ボルタ電池では、セル電位は正であり、自発反応を示す。電解セルでは、セル電位は負で、非自発的反応を示します。
- 電気化学セルの効率は、電極材料、電解液濃度、温度などの要因によって決まる。
- 電気化学セルは、エネルギー貯蔵、化学合成、環境浄化など、さまざまな技術応用において重要な役割を果たしている。
電解セルの構成要素
電気化学セルの一種である電解セルは、電気エネルギーを利用して非自発的な化学反応を駆動する装置である。陽極、陰極、電解液の3つの主要部品で構成される。
陽極
陽極は、電解槽の負極として機能する。電気化学反応中、陽極は電子を外部回路に放出し、酸化を受ける。言い換えれば、陽極は電子の損失と酸化が起こる場所である。
陰極
一方、正極は正極として機能する。外部回路から電子を獲得し、電気化学反応中に還元される。したがって、正極は電子の獲得と還元が行われる場所である。
電解質
電解質は、溶媒に溶けたり溶けたりしたときに移動性のイオンを含む物質である。電解セルでは、電解液が陽極と陰極の間のイオンの流れの媒体となり、電気回路を完成させる。一般的な電解質には、塩の水溶液や溶融塩がある。
ガルバニック電池との主な違い
電解セルは、いくつかの重要な点においてガルバニックセルと異なります:
- セル反応: セル反応:電解セルは非自発的な反応を駆動するために外部電気エネルギー源を必要とするが、ガルバニックセルは自発的な反応から電気エネルギーを生成する。
- エネルギーの流れ: 電解セルは非自発的反応を促進するために電気エネルギーを消費するが、ガルバニックセルは化学エネルギーを電気エネルギーに変換する。
- 電極の電荷: 電解槽では陽極がマイナス、陰極がプラスであるのに対し、ガルバニ電池では陽極がプラス、陰極がマイナスである。
電解セルの動作
電解槽の作動には、次のような手順がある:
- 外部電源(バッテリーなど)を電解セルの電極に接続する。
- 電源から電気エネルギーが供給され、非自発的な反応が促進される。
- 陽極では酸化が起こり、電子が外部回路に放出される。
- 電子は外部回路を通って陰極に流れる。
- 陰極では還元が起こり、外部回路から電子が消費される。
- 電解液中のイオンが移動して電気的中性を維持し、回路が完成する。
電解セルの用途
電解セルは、以下のような数多くの実用的な用途がある:
- 電気メッキ: 装飾や保護目的で表面に金属の薄層を析出させること。
- 水の電気分解: 水から水素と酸素を発生させ、燃料電池などに利用する。
- 化学物質の製造: 塩素、水酸化ナトリウム、アルミニウムなど、さまざまな化学物質を合成する。
- 金属の精製 電気分解によって不純物を取り除き、金属を精製すること。

電極電位と酸化還元反応
電気化学セルは酸化還元(レドックス)反応を促進する。このセルには、自発反応が起こるガルバニック(ボルタニック)セルと、非自発反応が起こる電解セルの2種類がある。
電気化学セルでは、酸化反応は陽極(マイナス端子)で起こり、還元反応は陰極(プラス端子)で起こる。電解セルでは、陽極は陰イオンを引き寄せてプラスになり、ガルバニックセルでは、自発的酸化反応による電子の放出によってマイナスになる。
電子の流れの方向と酸化還元反応の自発性は、電極間の電位差である電極電位によって決まる。標準水素電極(SHE)が基準点となり、電圧は0ボルトである。
電極電位を用いて予測できるセル電位は、測定された電位の推定値を提供する。セル電位を計算するには、ハーフセル反応方程式を釣り合わせ、電極電位間の電圧差を決定しなければならない。
電気化学セルでは、陰極と陽極がそれぞれ異なる役割を果たします:
陰極:
- 電子消費により正符号
- 還元反応が起こる
- 電子が入る
陽極:
- 電子放出により負符号
- 酸化反応が起こる
- 電子が出る
慣例により、電気化学電池を表す場合、陰極は右側に、陽極は左側に表される。
電気化学セルの応用
電気化学セルは、エネルギー貯蔵、変換、工業プロセスなど、さまざまな分野で幅広く応用されている。
電気めっき
電気メッキは、電気化学セルを使用して、別の金属の表面に金属の薄い層を適用するプロセスです。このプロセスは、耐食性、耐摩耗性、耐摩耗性など、母材の特性を向上させる。電気メッキは、自動車、電子機器、宝飾品などの産業で、機能性と美観の両方の目的で広く使用されている。
電池
電気化学セルが電池の基礎となり、多くの電子機器や電化製品に不可欠な部品となっている。電池は化学エネルギーを貯蔵し、必要なときに電気エネルギーに変換する。スマートフォンやノートパソコン、電気自動車など、携帯機器の電源として欠かせない。
電解採取と電解精製
電気化学電池は、金属を生産・精製する電解・電解精製プロセスで使用される。電解は、電気分解を使用して鉱石または他の供給源から金属を抽出することを含み、電解精製は不純物を除去することによって金属をさらに精製する。これらのプロセスは、銅、亜鉛、アルミニウムなど、様々な産業用途に不可欠な高純度金属を得る上で極めて重要である。
その他の用途
電気化学電池は、他にも様々な分野で応用されている:
- 水処理: 水処理:水の電気分解に使用され、燃料電池やその他の工業プロセスに不可欠な水素ガスと酸素ガスを生成する。
- 燃料電池: 電気化学セルは、水素と酸素の電気化学反応によって電気を発生させる燃料電池の中核部品である。
- 化学合成: 電気化学セルは、様々な化学物質や材料を製造する化学合成プロセスで利用することができる。
- センサーとバイオセンサー 電気化学電池は、電気化学的特性に基づいて特定の物質を検出・分析するセンサーやバイオセンサーに使用される。

まとめ
電気化学セル化学エネルギーを電気エネルギーに変換したり、逆に電気エネルギーを化学エネルギーに変換する能力を持つ電気化学セルは、様々な分野で不可欠なツールである。エネルギー貯蔵、変換、そして数多くの工業プロセスの基盤となっている。私たちの機器に電力を供給するバッテリーからクリーンエネルギーを生成する燃料電池に至るまで、電気化学電池は技術の進歩を形成し続けている。その原理と応用を理解することは、エネルギー技術、持続可能なソリューション、電気化学工学のさらなる革新にとって最も重要です。




















