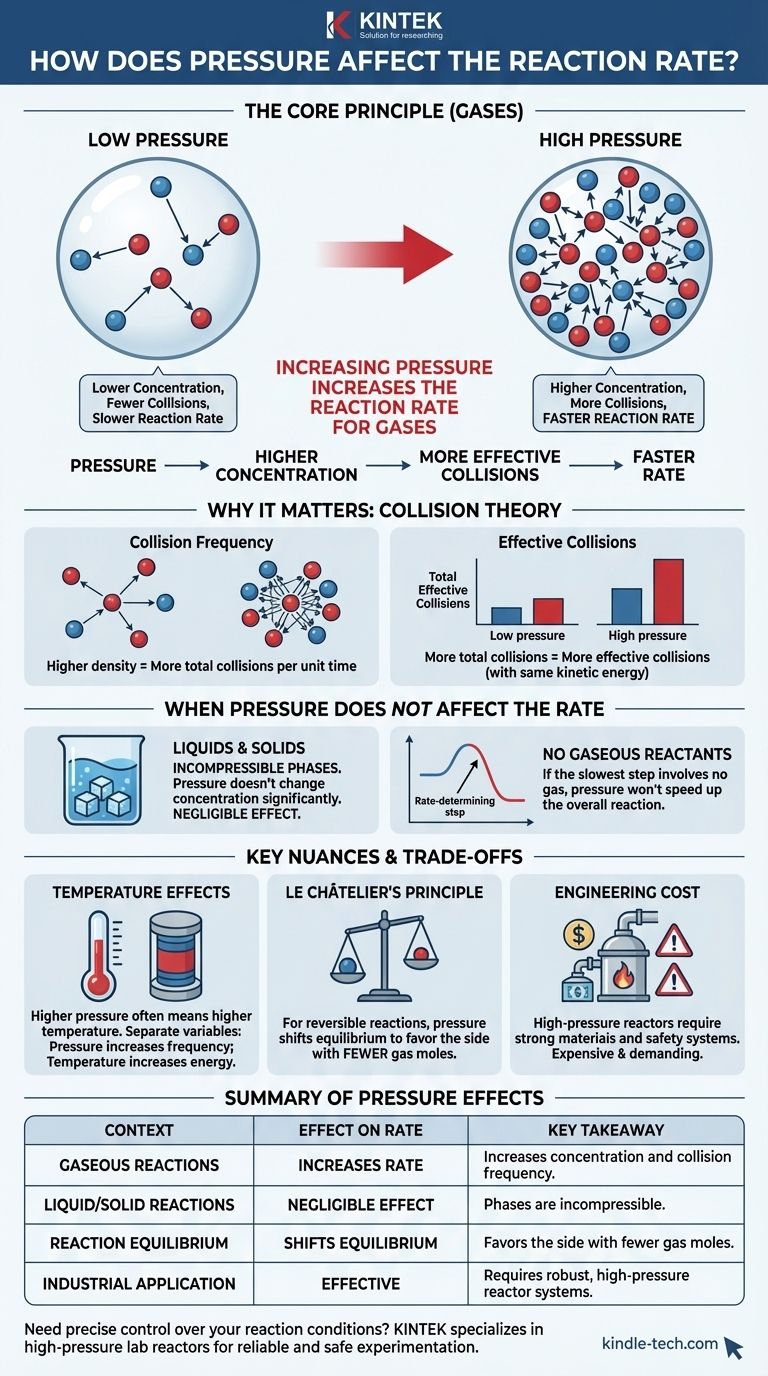
要するに、気体を含む反応の圧力を高めると、反応速度が増加します。これは、圧力が気体の濃度を直接的に示す尺度であるために起こります。気体分子をより小さな体積に圧縮することで、それらが衝突して反応する可能性が高まります。
核となる原理は、気体反応の場合、圧力が濃度に直接作用するレバーとして機能することです。圧力が高いほど、気体分子はより密接に押し合わされ、有効衝突の頻度が増加し、それによって反応が加速されます。この効果は、液体または固相での反応では無視できます。
基本的なメカニズム:なぜ圧力が重要なのか
圧力の影響を真に理解するためには、化学反応がどのように起こるかという第一原理に戻る必要があります。それはすべて、粒子が衝突するという概念を中心に展開します。
濃度としての圧力
気体にとって、圧力は抽象的な力ではありません。それは気体分子が容器の壁に衝突した結果です。
理想気体の法則は、一定の温度(T)において、圧力(P)と所定の体積(V)中のモル数(n)との間に直接的な関係があることを示しています。同じ空間により多くの分子があれば、より高い圧力になります。したがって、圧力を高めることは、機能的には濃度を高めることと同じです。
衝突理論の役割
化学反応は、反応物粒子が以下の2つの主要な条件を満たして衝突するときに起こります。
- 活性化エネルギー障壁を乗り越えるのに十分な運動エネルギーを持っていること。
- 正しい物理的配向で衝突すること。
両方の基準を満たす衝突を有効衝突と呼びます。反応速度は、これらの有効衝突の頻度によって決定されます。
圧力が増加すると衝突が増加する
気体システムの圧力を高めると、同じ数の分子をより小さな体積に押し込めることになります。
この高い密度は、分子間の平均距離が減少することを意味します。その結果、単位時間あたりの反応分子間の総衝突数が大幅に増加します。
「有効」衝突への影響
圧力の増加は総衝突数を増加させますが、個々の分子の運動エネルギーは変化させません(温度が一定であると仮定した場合)。
したがって、有効な衝突の割合は同じままです。しかし、総衝突数が増加したため、1秒あたりの有効衝突の絶対数も増加します。これが反応速度を向上させる要因です。

圧力が反応速度に影響を与えない場合
圧力と反応速度の間の関連性は強力ですが、普遍的ではありません。それが適用されない場合を知ることが重要です。
液体および固相での反応
液体および固体は非圧縮性相と見なされます。外部圧力を加えても、その体積や構成粒子の間隔は大きく変化しません。
圧力の変化は液体や固体中の反応物の濃度を変えないため、圧力はこれらの相のみで起こる反応の速度に無視できる影響しか与えません。
気体反応物を含まない反応
反応メカニズムが複数のステップを含む場合、全体の速度は最も遅いステップ、つまり律速段階によって決定されます。
この律速段階に気体反応物が関与しない場合、外部圧力の変化は全体の反応速度に影響を与えません。
トレードオフとニュアンスの理解
圧力制御は一般的な工業戦略ですが、単純な速度変化を超えた重要な考慮事項が伴います。
温度効果との区別
実際には、気体を圧縮すると温度が上昇します。高圧と高温の両方が反応速度を増加させますが、その理由は異なります。
変数を分離することが重要です。圧力は衝突の頻度を増加させるのに対し、温度は衝突のエネルギーと力を増加させ、それらの衝突のより高い割合を有効にします。
ルシャトリエの原理と平衡
平衡状態に達する可逆反応の場合、圧力は二重の役割を果たします。ルシャトリエの原理によれば、圧力を高めると、平衡位置はガス分子の数が少ない反応側に有利になるように移動します。
これは反応速度論(速度)とは別の概念です。圧力は正反応と逆反応の両方の速度を増加させますが、生成物と反応物の最終的なバランスを変化させる可能性があります。
高圧のエンジニアリングコスト
高圧反応器の構築と維持は、技術的に要求が高く、費用がかかります。材料は応力に耐えるのに十分な強度が必要であり、壊滅的な故障を防ぐために広範な安全システムが求められます。この経済的および安全上のトレードオフは、工業プロセス設計における主要な要因です。
これをあなたの目標に適用する
圧力を使用する方法は、あなたが扱っている化学システムと達成しようとしている目標に完全に依存します。
- 気体プロセスでの反応速度の最大化が主な焦点の場合: 圧力の増加は、関連する温度変化とエンジニアリングコストを管理できる限り、直接的で効果的な方法です。
- 化学平衡を研究している場合: 圧力は反応速度と最終的な平衡位置の両方に影響を与え、ガス分子の少ない側に有利に働くことを忘れないでください。
- 反応が液体または固体のみを含む場合: 外部圧力を変更することは、反応速度を制御するための実行可能な戦略ではありません。代わりに、温度、濃度、または触媒に焦点を当ててください。
圧力と濃度の直接的な関連性を理解することで、気体反応の反応速度論を制御するための強力な手段を得ることができます。
要約表:
| 反応速度に対する圧力の影響 | 重要なポイント |
|---|---|
| 気体反応 | 濃度と衝突頻度を増加させることで速度を向上させる。 |
| 液体/固体反応 | 無視できる影響。相は非圧縮性。 |
| 反応平衡 | ガスモル数の少ない側に有利になるように平衡を移動させる。 |
| 工業的応用 | 効果的だが、堅牢な高圧反応器システムが必要。 |
反応条件の精密な制御が必要ですか? KINTEKは、信頼性と安全性の高い実験のために設計された高圧ラボ反応器と機器を専門としています。気体反応速度の最適化であろうと化学平衡の研究であろうと、当社のソリューションは必要な性能と安全性を提供します。今すぐ専門家にお問い合わせください。お客様のラボの独自の課題に最適なシステムを見つけます。
ビジュアルガイド
関連製品
- 高度な科学および産業用途向けのカスタマイズ可能な高圧反応器
- ステンレス製高圧オートクレーブ反応器 実験室用圧力反応器
- 実験用ミニSS高圧オートクレーブ反応器
- 実験室用高圧管状炉
- 熱水合成用高圧実験室オートクレーブ反応器



















