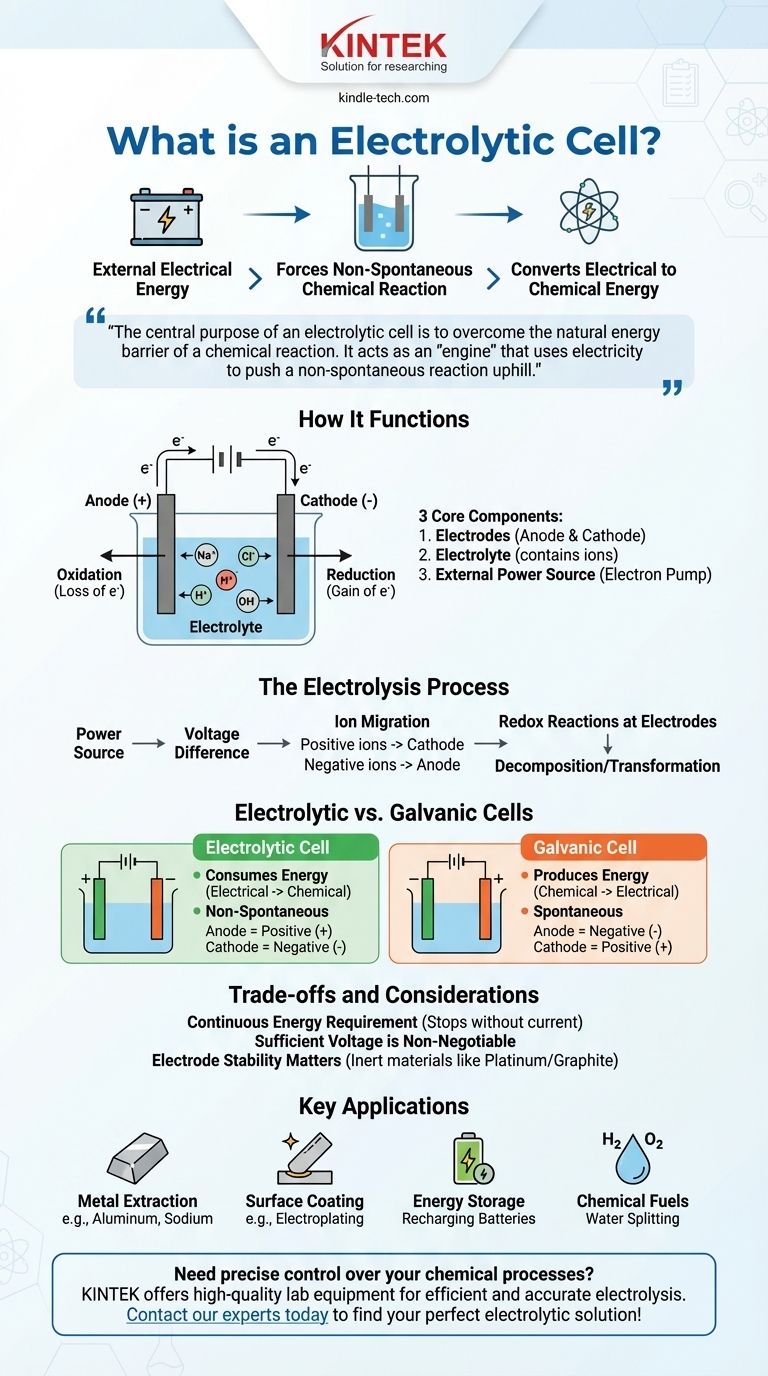
本質的に、電気分解セルとは、バッテリーなどの外部電源から供給される電気エネルギーを使用して、それ自体では起こらない化学反応を強制する装置です。電気分解として知られるこのプロセスは、水や溶融塩などの化合物を分解することにより、電気エネルギーを貯蔵された化学エネルギーに変換します。
電気分解セルの中心的な目的は、化学反応の自然なエネルギー障壁を克服することです。これは、電気を使用して非自発的な反応を「坂道」を上らせ、元素の分離やバッテリーの充電などのタスクを達成する「エンジン」として機能します。
電気分解セルの機能
電気分解セルを理解するためには、その必須部品とそれらが可能にするプロセスを見る必要があります。システム全体は、特定の化学変化を駆動するために、電子とイオンの流れを制御するように設計されています。
3つの主要コンポーネント
電気分解セルは、主に3つの部分から構成されています。
-
電極(陽極と陰極):これらは、化学反応の場となる2つの金属または電子導体です。陽極は酸化(電子の損失)が発生する正の電極であり、陰極は還元(電子の獲得)が発生する負の電極です。
-
電解質:これは、通常、液体溶液または溶融塩であり、自由に移動できるイオンを含んでいます。電解質は、2つの電極間で電荷が流れることを可能にし、電気回路を完成させます。
-
外部電源:これは、バッテリーやDC電源などの重要なコンポーネントです。これは「電子ポンプ」として機能し、陽極から電子を引き抜き、陰極に押し込みます。
電気分解のプロセス
電源は電極間に電圧差を生じさせます。
これにより、電解質中のイオンの移動が強制されます。正に帯電したイオンは負の陰極に向かって移動し、負に帯電したイオンは正の陽極に向かって移動します。
電極では、酸化還元(電荷移動)反応が発生します。陽極では物質が電子を失い、陰極では物質が電子を獲得し、電解質の構成要素の分解または変換が起こります。

重要な違い:電気分解セルとガルバニ電池
一般的な混乱のポイントは、電気分解セルと、私たちが通常標準的なバッテリーと考えるガルバニ電池(またはボルタ電池)との違いです。
エネルギー変換
電気分解セルはエネルギーを消費します。電気エネルギーを化学エネルギーに変換します。
ガルバニ電池はエネルギーを生成します。貯蔵された化学エネルギーを電気エネルギーに変換します。
反応の自発性
電気分解セルの反応は非自発的です。進行するには外部からのエネルギー入力が必要です。
ガルバニ電池の反応は自発的です。自然に発生し、その過程でエネルギーを放出します。
電極の極性
電気分解セルでは、陽極は正、陰極は負になります。これは、外部電源が電荷を決定するためです。
ガルバニ電池では、陽極は負、陰極は正になります。自発的な化学反応自体が電荷を決定します。
トレードオフと考慮事項の理解
電気分解セルは強力ですが、認識しておくべき特定の制約の下で動作します。
継続的なエネルギー要件
電気分解セルの主な特徴は、外部電源への依存性です。電気の流れがなくなると、電気分解のプロセスは停止します。
十分な電圧は交渉の余地がない
印加される外部電圧は、非自発的な反応の自然な抵抗を克服するのに十分な高さでなければなりません。電圧が低すぎると、化学変化は起こりません。
電極の安定性が重要
電極自体も慎重に選択する必要があります。多くのプロセスでは、それらは反応を消費されることなく促進する白金やグラファイトなどの不活性材料で作られています。他の用途では、一部の種類の精製で見られるように、電極材料は意図的に反応に参加するように選択されます。
電気分解セルの主要な用途
化学反応を強制する能力により、電気分解セルは産業と技術において中心的な役割を果たします。
- 純粋な元素の生成に主に焦点を当てる場合:電気分解は、鉱石(ボーキサイト)からアルミニウムなどの金属を抽出したり、溶融塩化ナトリウムからナトリウムと塩素ガスを生成したりするために使用されます。
- 表面コーティングに主に焦点を当てる場合:電気めっきプロセスでは、電気分解セルを使用して、保護または装飾のために別の金属の上に別の金属(クロムや金など)の薄い層を堆積させます。
- エネルギー貯蔵に主に焦点を当てる場合:バッテリーの充電は、それを電気分解セルとして動作させることを伴います。外部充電器はイオンを元の状態に戻すように強制し、後で使用するためにエネルギーを貯蔵します。
- 化学燃料の生成に主に焦点を当てる場合:電気分解セルは水をH₂Oから水素ガスと酸素ガスに分解でき、水素はクリーンな燃料源として機能します。
電気エネルギーを正確に印加することにより、電気分解セルは化学変換に対する直接的な制御を私たちに与えます。
要約表:
| 特徴 | 電気分解セル | ガルバニ電池(バッテリー) |
|---|---|---|
| エネルギー変換 | 電気エネルギーを化学エネルギーに変換 | 化学エネルギーを電気エネルギーに変換 |
| 反応タイプ | 非自発的(外部電源が必要) | 自発的(自然に発生) |
| 陽極の電荷 | 正 | 負 |
| 主な機能 | 望ましい化学反応を駆動する(例:電気めっき) | 発電 |
化学プロセスに対する正確な制御が必要ですか? KINTEKの高品質なラボ機器(信頼性の高い電源や耐久性のある電極を含む)は、効率的で正確な電気分解に不可欠です。電気めっき、金属精製、エネルギー貯蔵研究など、お客様の用途に関わらず、当社の消耗品と機器は優れた性能を発揮するように設計されています。当社の専門家に今すぐお問い合わせいただき、お客様の研究室のニーズに最適な電気分解ソリューションを見つけてください!
ビジュアルガイド
関連製品
よくある質問
- 95%硫酸の煮沸に石英腐食セルが選ばれるのはなぜですか? 317℃での安全性とデータの完全性を確保
- 電気分解セルのセットアップにおける電極の極性に関する重要な注意点は何ですか?高価な失敗や実験の失敗を避けましょう
- 二相ステンレス鋼の特性評価に電解エッチング装置はどのように使用されますか?マイクロ構造解析をマスターする
- 透明アクリル電解セルはどのような機能を持っていますか?可変ギャップ電解の研究を最適化する
- H型電解セルを使用する前に、どのような点検を行うべきですか?実験の安全性とデータの正確性を確保してください。
- ゼロギャップCO2還元におけるイオン交換膜の役割とは?選択的輸送のエンジンをマスターする
- 二重層水浴電解槽の一般的な容量と開口部の構成は?電気化学的セットアップを最適化する
- 炭素鋼に専用の電気化学試験セルが必要なのはなぜですか?地熱腐食データを正確に保証する



















