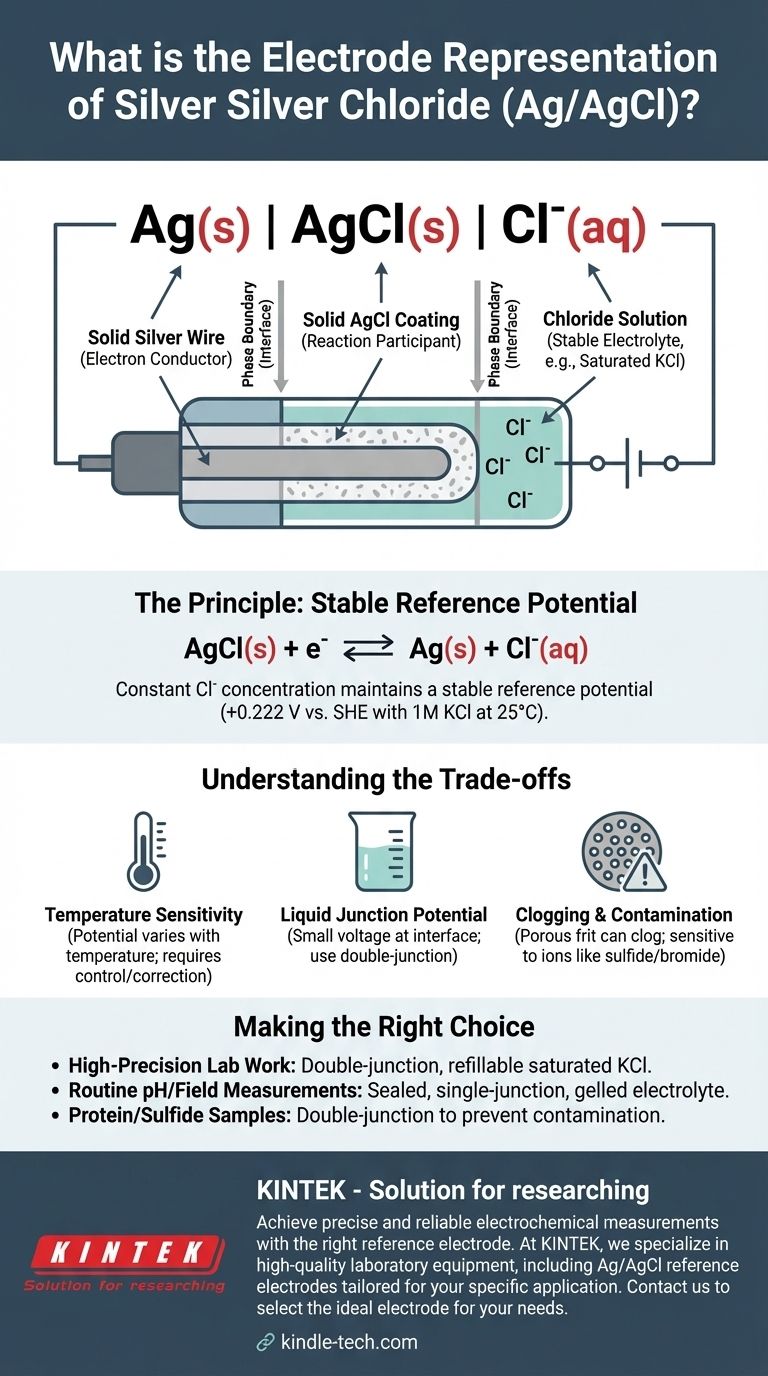
銀-塩化銀電極の標準的な略記法は、Ag(s) | AgCl(s) | Cl⁻(aq)です。この電気化学的表記法は、固体銀金属線から塩化物イオンを含む水溶液に至るまで、電極の物理的および化学的相を示します。電極の特定の電位は、これらの塩化物イオンの濃度に決定的に依存します。
この表記法は単なる技術的なラベルではなく、電気化学において最も信頼性が高く一般的な参照電極の1つの概略図です。これは、一定で安定した電位を維持するように設計されたシステムを表しており、他の電極の電位を正確に測定するための固定された基準点を提供します。
電極表記法の分解
表記法Ag(s) | AgCl(s) | Cl⁻(aq)は、電極の構造を内側から順に詳述しています。各構成要素と記号には正確な意味があります。
固体相:Ag(s)
これは固体銀線を表します。この線は電子伝導体として機能し、電極を外部測定回路(電圧計またはポテンショスタット)に接続します。
相境界:|
単一の縦棒|は相境界を示します。これは、2つの異なる物理的状態(この場合は固体銀金属と固体塩化銀層)が出会う界面を示します。
難溶性塩層:AgCl(s)
これは、銀線の表面に直接コーティングされた固体で難溶性の塩化銀の層を示します。この層は電極機能の核心であり、電気化学反応に直接関与します。
第2の相境界:|
2番目の縦棒は、固体塩化銀コーティングと周囲の水性電解質溶液との境界を示します。
電解質溶液:Cl⁻(aq)
これは、コーティングされた線が浸漬されている水溶液を表します。この溶液には、既知の一定濃度の塩化物イオン(Cl⁻)が含まれている必要があります。通常、塩化カリウム(KCl)溶液が使用され、多くの場合、1 Mや、最も一般的には飽和溶液などの特定の濃度で使用されます。

参照電極の原理
Ag/AgCl電極が評価されるのは、その反応そのものではなく、その安定性のためです。これは、他の測定の信頼できるゼロ点として機能する一定の電圧を提供します。
支配的な反応
安定した電位は、固体構成要素と溶液中の塩化物イオンとの間の可逆的な平衡によって確立されます。半反応は次のとおりです。
AgCl(s) + e⁻ ⇌ Ag(s) + Cl⁻(aq)
溶液中の塩化物イオンの濃度(より正確には活量)が一定である限り、この半電池の電位は変化しません。
一定の塩化物濃度の重要性
飽和KCl溶液を使用することで、Cl⁻濃度が一定で再現可能であることが保証されます。水が蒸発しても、飽和を維持するためにさらにKCl塩が溶解します。これが参照電位が非常に安定している理由です。25°C(298 K)の1M KCl溶液の場合、この電位は標準水素電極(SHE)に対して+0.222 Vです。
トレードオフの理解
Ag/AgCl電極は非常に信頼性が高いですが、精密な作業においては考慮すべき限界がないわけではありません。
温度感度
電極の電位は温度の関数です。非常に正確な測定を行うには、セルの温度を制御するか、測定された電位を温度変化に対して補正する必要があります。
液絡電位
電極のKCl溶液が異なるサンプル溶液と接触すると、液絡電位として知られる小さな電圧が界面で発生する可能性があります。これは測定にわずかながら系統的な誤差をもたらしますが、二重液絡電極を使用することで最小限に抑えることができます。
目詰まりと汚染
内部溶液とサンプルの電気的接触を可能にする多孔質フリットが目詰まりすることがあります。また、サンプル中のイオン(硫化物、臭化物、またはヨウ化物など)が銀と反応し、電極電位が時間とともにドリフトする原因となることで汚染される可能性もあります。
測定に最適な選択をする
お客様の用途によって、最適な電極構成が決まります。
- 高精度の実験室作業が主な焦点の場合: 液絡電位を最小限に抑え、簡単なメンテナンスを可能にするために、充填可能な飽和KCl溶液を備えた二重液絡Ag/AgCl電極を使用してください。
- 日常的なpH測定や現場測定が主な焦点の場合: ゲル状電解質を備えた密閉型シングルジャンクション電極は、耐久性があり、メンテナンスが少なく、完全に適切です。
- タンパク質や硫化物を含むサンプルの分析が主な焦点の場合: 主参照液絡の目詰まりや汚染を防ぐために、二重液絡電極を使用する必要があります。
この表記法を理解することは、それを難解なラベルから信頼できる電気化学測定のための機能的な概略図へと変貌させます。
要約表:
| 構成要素 | 記号 | 説明 |
|---|---|---|
| 固体銀線 | Ag(s) | 外部回路に接続する導体。 |
| 塩化銀コーティング | AgCl(s) | 可逆反応を可能にする難溶性塩層。 |
| 塩化物イオン溶液 | Cl⁻(aq) | 一定のCl⁻濃度を持つ水性電解質(例:KCl)。 |
| 相境界 |
適切な参照電極を選択して、正確で信頼性の高い電気化学測定を実現しましょう。
KINTEKでは、高精度の二重液絡モデルが必要なデリケートな実験作業であれ、日常的な分析に適した耐久性のある低メンテナンスオプションであれ、お客様の特定の用途に合わせて調整された幅広いAg/AgCl参照電極を含む高品質の実験装置を専門としています。
当社の専門家が、安定した電位を確保し、誤差を最小限に抑え、研究の精度を高めるために最適な電極の選択をお手伝いします。
KINTEKに今すぐお問い合わせいただき、お客様の実験室のニーズについてご相談の上、当社の信頼できる消耗品と機器がお客様の研究をどのようにサポートできるかをご確認ください。
ビジュアルガイド
関連製品
- 実験室用参照電極 カロメル 銀塩化水銀 硫酸水銀
- 金属ディスク電極 電気化学電極
- 電気化学用途向け回転白金ディスク電極
- 金ディスク電極
- RRDE 回転ディスク(リングディスク)電極 / PINE、日本ALS、スイスMetrohm ガラスカーボン プラチナ対応
よくある質問
- なぜ黒鉛は熱に耐えられるのか?実験室での極限の熱安定性を解き明かす
- CuOxナノワイヤ合成におけるカソードとして白金メッシュを使用する利点は何ですか?純度と均一性を確保する
- 白金チタン機能電極の仕様は何ですか?電気化学的性能を最大化するには
- 白金化チタンメッシュを使用する利点は何ですか?触媒効率と耐久性の向上
- 炭素フォームサポートに高い化学的安定性が要求されるのはなぜですか? 水電解における長期耐久性を確保する
- 金メッキ電極の維持管理と手入れの重要な側面は何ですか?性能を維持し、寿命を延ばす
- ガス拡散電極(GDE)の主な機能は何ですか?CO2電解における物質移動の促進
- カーボンファイバーブラシを交換すべき条件は?性能を確保するための重大な故障を特定する



















