電極の定義と機能
目次
電極の説明
電極は、電流が電解質に出入りする点です。回路の非金属部分との接合に使用される導体です。電極は、金、プラチナ、カーボン、グラファイト、金属などの材料で作ることができます。それらは、電気化学セルにおける酸化還元反応の表面として機能します。電極には、アノードやカソードなど、さまざまな種類があります。
電気化学セルにおける電極の役割
電極は電気化学セルの必須コンポーネントです。これらは、セル内で生成された電子をある半電池から別の半電池に輸送し、電荷を生成します。カソードは電流がセルから出る電極であり、アノードは電流が入る電極です。セル内の電解質は、カソードとアノードの間の電子の流れの導管として機能します。セル電位は、基準電位を 0 ボルトとした標準電極システムに基づいて計算されます。

アノードとカソードの違い
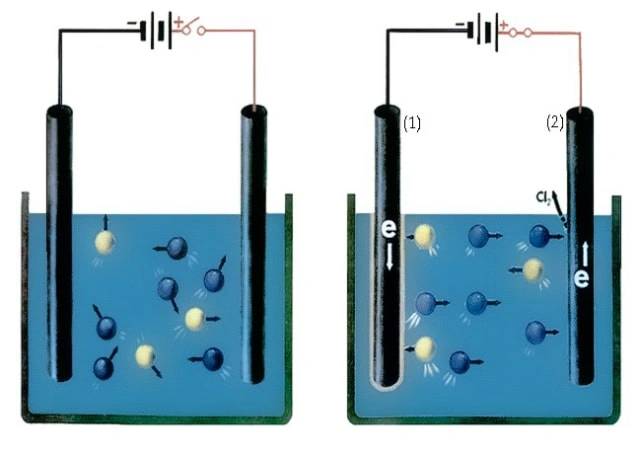
電気化学セルでは、アノードとカソードは異なる役割を果たします。電解槽では陰極がマイナスに帯電しており、この電極で還元反応が起こります。電池の動作中に電子がカソードに移動します。一方、電解槽では陽極がプラスに帯電しており、この電極で酸化反応が起こります。電池の動作中、電子はアノードから移動します。アノードとカソードの役割は電子の流れの方向に応じて変わる可能性があることに注意することが重要です。
要約すると、電極は、電子の伝達を促進するために電気化学セルで使用される導体です。これらはこれらの電池の機能において重要な役割を果たしており、発生する化学反応の種類に基づいてアノードまたはカソードとして分類されます。電極の役割と機能を理解することは、電気化学の研究において不可欠です。
電極の仕組み
電極表面での酸化と還元の過程
電極は、金属と金属が置かれている溶液との間に酸化還元平衡が確立される金属表面です。電極は、アノードまたはカソードのいずれかになります。
アノード: アノードは電解質混合物から電流または電子を受け取り、酸化させます。原子または分子がアノードの表面に近づくと、溶液から電子が与えられ、その結果、陽イオンが形成されます。
陰極: 一方、陰極は溶液中に電子を放出し、還元を引き起こします。
電極が犠牲的な場合や特定のプロセスに使用される場合を除き、電極は安定しており、耐腐食性を備えている必要があります。機械的作用により、グラファイト粒子の放出などの電極の劣化が生じる可能性があり、濾過が必要になる場合があります。特定の材料では、電極の膨張が問題となる場合もあります。
これらのプロセスにおけるアノードとカソードの役割
アノードとカソードは、バッテリー、燃料電池、太陽電池、電解セル、ダイオードなどの電気化学システムにおいて重要な役割を果たします。

アノード: アノードとは、酸化が起こる、または電子が流出する電極を指します。これは、電子が電気化学セルから出て酸化を引き起こす端子または導体です。一次電池では、アノードは固定されており再充電できませんが、二次電池では、電流の方向に応じてアノードの極性が変化します。
カソード: カソードとは、還元が起こる、または電子が流入する電極を指します。電子はカソードからセルに入り、還元反応に関与します。アノードと同様に、カソードも二次電池の極性を変更できます。
電極の腐食は、特に電解液の電位が変動している場合、またはアノードとカソードとして異なる金属が使用されている場合に深刻になる可能性があります。ただし、阻害剤やその他の予防方法は、電極による攻撃を軽減するのに役立ちます。
電気分解は、電気エネルギーを使用して非自発的な化学反応を実行する電解槽内で発生するプロセスです。酸化はアノード (プラスのプレート) で発生し、還元はカソード (マイナスのプレート) で発生します。
酸化と還元のプロセスやアノードとカソードの役割を含む電極の機構を理解することは、さまざまな電気化学的用途において重要です。
電極の材料構成
電極材料の要件
電気化学セルの効率は、電極の物理的特性によって決まります。電極の材料組成は、その性能に重要な役割を果たします。電極材料の主な要件は導電性です。金属、半導体、グラファイト、導電性ポリマーなどの任意の導電性材料を電極として使用できます。多くの場合、電極は材料の組み合わせで構成され、それぞれに特定の役割があります。これらの資料には次のものが含まれます。
- 活物質: 電極内で酸化または還元を受ける粒子です。
- 導電剤: 電極の導電性を向上させます。
- バインダー: 電極内に活性粒子を含めるために使用されます。
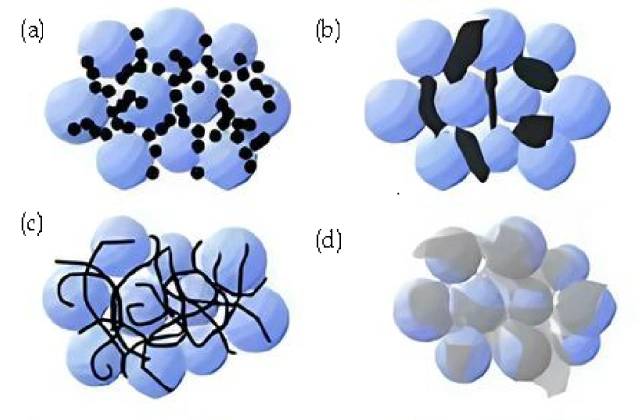
![導電剤の概要 (a. カーボン ブラック、硬質ナノ粒子、点対点接触。 b. 導電性グラファイト、硬質ミクロン粒子、点対点接触。 c. カーボン ナノチューブ、柔軟; 線と点接触 d. グラファイト、柔軟なシート、面および点接触。)]()
導電剤の概要 (a. カーボン ブラック、硬質ナノ粒子、点対点接触。 b. 導電性グラファイト、硬質ミクロン粒子、点対点接触。 c. カーボン ナノチューブ、柔軟; 線と点接触 d. グラファイト、柔軟なシート、面および点接触。)
導電率に加えて、電極の他の重要な特性には、電気抵抗率、比熱容量、電極電位、および硬度が含まれます。材料のコストも、技術的応用において考慮すべき重要な要素です。
不活性電極と反応性電極の例
電極は、酸化還元 (レドックス) 反応への関与に応じて、不活性または反応性のいずれかになります。不活性電極は反応に関与せず、化学的に反応しません。不活性電極の例には、グラファイト (カーボン)、白金、金、ロジウムなどがあります。これらの材料は、電極の唯一の目的が電気化学セル内の電流の流れを促進することである場合に使用されます。
一方、反応性電極は酸化還元反応に積極的に関与します。これらは反応物とともに酸化または還元を受けます。たとえば、マグネシウム電極は反応に関与するため、活性電極です。不活性電極と反応性電極のどちらを選択するかは、電気化学プロセスの特定の要件によって異なります。
反応における電極の役割
電極は、酸化還元反応が起こるプラットフォームとして機能します。場合によっては、固体の反応物質が電極として使用されます。たとえば、銅と銀の電気化学セルでは、銅と銀は両方とも反応物質であり、電極でもあります。反応物電極は、酸化還元反応中の電子とイオンの移動を促進します。
あるいは、不活性電極が必要な反応では、反応に関与しない金属が使用されます。この例としては、標準水素電極 (SHE) 反応における白金が挙げられます。不活性電極により、化学反応を妨げることなく電流が流れます。
電極材料の選択は、電気化学プロセスにおいて最適な収率と選択性を達成するために重要です。材料の特性は電子移動の速度論と熱力学に影響を与え、変換の成功または失敗を決定する可能性があります。コスト、安定性、さまざまな形状への操作性などの考慮事項も、適切な電極材料を選択する際に重要な役割を果たします。
電極の材料組成と内部構造は、その性能を決定する重要な要素です。電極スラリー中の活物質、導電剤、バインダーの組み合わせにより、その導電性と機能性が向上します。次に、混合物は導体上にコーティングされ、電気化学セルの集電体として機能します。
要約すると、電極の材料組成は、不活性か反応性かにかかわらず、電気化学プロセスにおける効率と機能に大きな影響を与えます。電極材料の選択は、導電性、安定性、コストなどの要素を考慮して、アプリケーションの特定の要件に基づいて行う必要があります。
電極の例
一般的に使用される不活性電極および反応性電極の例
活性電極と不活性電極は区別できます。たとえば、マグネシウム電極は酸化還元 (レドックス) 反応に関与するため、通常は活性電極です。白金電極は酸化還元反応に関与しないため、通常は不活性電極です。不活性電極は化学的に反応せず、電気化学セルに電流が流れるためにのみ存在します。
分析化学における電極の例
分析化学の電極に使用される代表的な材料の例としては、アモルファスカーボン、金、白金などがあります。ガラス電極は pH 測定によく使用されます。この用途では、ガラスは水素イオンに対して選択的になるように化学的にドープされています。
電池の電極例
電池には、電池の種類に応じてさまざまな電極が含まれています。
- 鉛蓄電池は鉛電極をベースとしています。
- 亜鉛炭素電池は、亜鉛電極とアモルファス炭素電極で作られています。
- リチウムポリマー電池には、固体ポリマーマトリックスで作られた電極があり、その中でリチウムイオンが移動し、電荷担体として機能します。
![鉛蓄電池、亜鉛炭素電池、リチウムポリマー電池]()
鉛蓄電池、亜鉛炭素電池、リチウムポリマー電池
電気分解における電極の例
電気エネルギーを使用して、塩や鉱石を金属に変換できます。
- 酸化アルミニウムから金属アルミニウムを抽出するホール・エルー法では、アノードとカソードは両方ともグラファイトでできています。
- 金属ナトリウムは、炭素陽極と鉄陰極を使用した電気分解によって生成されます。
不活性電極
いかなる化学反応にも干渉したり関与しない金属は、不活性電極として知られています。ただし、イオンを交換する代わりに、溶液に電子を通すことで電気を伝達するために今でも使用されています。
不活性電極の例としては、グラファイト、白金、金、ロジウムなどが挙げられます。
定量分析における電極
電位差分析では、指示電極は分析物の活性または「有効濃度」の違いに応答します。この単純さにより、電位差測定は原子分光法やイオンクロマトグラフィーと比較して経済的な技術となります。これらの手順は、制御されるセルの側面に基づいて分類できます。
電極の用途
電極は、非金属物体に電流を供給してさまざまな方法で変化させたり、さまざまな目的で導電率を測定したりするために使用されます。例としては次のようなものがあります。

- 燃料電池用電極
- EEG (脳活動を記録する)、ECG (心拍を記録する)、ECT (脳電気刺激)、除細動器 (心臓刺激を記録して伝達する) などの医療目的の電極
- 生物医学研究における電気生理学技術用の電極
- 電気椅子による処刑用の電極
- 電気めっき用電極
- アーク溶接用電極
- 陰極防食用電極
- アース用電極
- 電気化学的手法を用いた化学分析用電極
- ナノ電気化学における高精度測定のためのナノ電極
- 電解用不活性電極(白金製)
- 膜電極接合体
- テーザー電気ショック兵器用の電極
標準水素電極(SHE)
SHEの定義と重要性
標準水素電極 (SHE) は、科学者がすべての半電池電位反応の基準として使用する電極です。標準電極電位の値はゼロであり、異なる電極または濃度を使用して細胞電位を計算するための基礎となります。 SHE のような共通の参照電極を持つことは、電気化学実験における正確な測定と比較にとって非常に重要です。
SHEの材料組成と反応過程
SHE は、白金メッキされたプラチナの正方形片を含む 1.0 M H+(aq) 溶液で構成されています。白金は白金ワイヤに接続されており、電子交換が可能です。ガラス管内で水素ガスが溶液中に通過し、次の反応が起こります。
2H+(aq) + 2e- ⇌ H2(g)
水素イオンと水素ガスの間のこの平衡により、SHE の基準電位が確立されます。

SHE のセットアップと使用における課題
SHE のセットアップと使用には、いくつかの課題が生じる可能性があります。課題の 1 つは、経時的および温度変化に対する参照電極の安定性を確保することです。 SHE のコンポーネントは安定しており、固定された再現可能な電極電位を提供する必要があります。
もう 1 つの課題は、参照電極の構造にあります。 SHE は、上部に小さな入口と下部に複数の出口を備えたガラス ジャケットで構成されています。ガラスジャケットの内側には両端が封止されたガラス管があり、その下端には白金メッキ線と白金メッキプレートが入っています。ガラスジャケットとチューブを 1 M HCl 溶液の入った容器に浸します。 SHE が正確に機能するには、これらのコンポーネントを適切に構築することが不可欠です。
要約すると、標準水素電極は電気化学において重要なツールであり、電極電位を測定および比較するための基準として機能します。実験測定における安定性と精度を確保するには、その構造と使用に細心の注意が必要です。
3 電極システム
3 電極システムはボルタンメトリーにおいて不可欠なコンポーネントです。作用電極、参照電極、補助電極の 3 つの電極で構成されます。各電極はシステム内で特定の役割を果たします。
3 電極システムの説明
3 電極システムは、電気分析化学でボルタンメトリー分析を実行するために使用されます。これにより、電気化学セル内の電流の測定と制御が可能になります。このシステムは次の電極で構成されます。
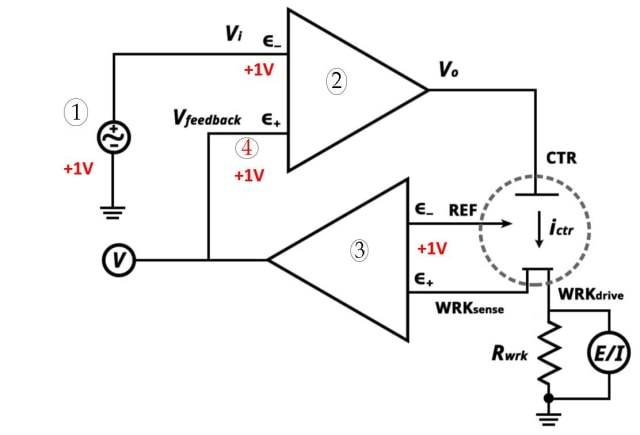
作用電極: 作用電極は、細胞内に存在する物質との間で電子を輸送する役割を果たします。ボルタンメトリー中に発生する電気化学反応を促進します。
参照電極: 参照電極には、確立された電極電位があります。電気化学電池の半電池として使用できます。作用極の電位を参照極と比較することにより、作用極の電極電位を求めることができる。
補助電極: 補助電極は、電流が基準セルを通過しないようにします。電流と作用電極の電流のバランスをとります。補助電極は対極とも呼ばれます。
![3 電極システム (1. 定電位設定値 2. 高利得オペアンプ 3. 電位計 4. 非常に近い)]()
3 電極システム (1. 定電位設定値 2. 高利得オペアンプ 3. 電位計 4. 非常に近い)
作用電極、参照電極、補助電極の役割
3 電極システムでは、各電極が特定の役割を果たします。
作用電極は、細胞内の物質との間で電子を輸送することにより、電気化学反応を促進します。
参照電極は、作用電極の電位を測定できる既知の電極電位を提供します。これは、作用電極の電極電位を決定するための基準点として機能します。
対極としても知られる補助電極は、電流が参照電極を通らずに電気化学セルに流れることを保証します。電流と作用電極の電流のバランスをとります。
3 電極システムには、2 電極セットアップに比べて明確な利点があります。これにより、作用電極の分離が可能になり、正確かつ確実に特定の反応を研究できるようになります。この設定は電気化学実験でよく使用されます。
一方、2 電極セットアップは、バッテリー、燃料電池、スーパーキャパシタなどの電気化学エネルギー デバイスなど、セル全体の電圧の測定が重要な場合に使用されます。対電極の電位が実験全体を通じて安定していることが予想される場合にも使用できます。
全体として、3 電極システムはボルタンメトリーにおいて重要なツールであり、電気化学反応の正確な測定と制御を可能にします。
参照電極の例
カロメル電極の説明とプロセス
カロメル電極はサイドアームを備えたガラス管で構成されています。チューブの底には、電気接続のために白金線が封入された純水銀があります。水銀の上には、水銀中の塩化第一水銀(カロメル)のペーストがあります。チューブの残りの部分は飽和 KCl 溶液で満たされます。サイドアームは、カロメル電極の結合に使用される溶液に浸すために使用されます。

動作: カロメル電極は負極として機能し、結合される他の電極の性質に応じて 2 つの反応が可能です。負極として機能すると、次の反応が起こります。
- 2Hg(l) → 2Hg+ + 2e–
- 2Hg+ + 2Cl- → Hg2Cl2(s)
正味の酸化反応は塩化第一水銀の形成です。
カロメル電極の利点:
- 標準水素電極(SHE)に比べて製作・メンテナンスが比較的容易
- 固体ペーストと液体水銀で構成されており、使いやすい
- KCl溶液が入った側管がすでに含まれているため、別の塩橋は必要ありません。
- 時間やわずかな温度変化に対して電位はあまり変化しません
カロメル電極の欠点:
- 半電池電位測定時には電位補正が必要
- K+イオンやCl-イオンが干渉する電位測定には使用できません
- 酸化電位は KCl の濃度に依存するため、濃度の変化は電極の電位に影響を与える可能性があります。
銀塩化銀電極の説明とプロセス
銀塩化銀電極は、カロメル電極と比較して手頃な価格で毒性が低いため、参照電極として広く使用されています。この電極は、固体の銀とその沈殿した塩である AgCl で構成されています。これは、純銀のワイヤーを AgCl でコーティングし、KCl と AgCl 溶液のチューブに浸すことによって作成されます。

動作: 銀-塩化銀電極により、イオンが形成され、電子が電極システムに出入りすることができます。別の電極と組み合わせると、参照電極として機能します。
銀-塩化銀電極の利点:
- 安価で広く入手可能
- カロメル電極と比較して毒性が低い
- セットアップと再現が簡単
- 便利で持ち運びが簡単
- コンパクトで小型なのでスペースをとりません
- KCl溶液が入った側管がすでに含まれているため、別個の塩橋は必要ありません。
- 時間が経っても、わずかな温度変化に対しても、電位は比較的安定しています。
参照電極は、センス測定に安定した一定の電位を提供するため、電気化学分析には不可欠です。カロメル電極と銀-塩化銀電極は、水系電気化学で一般的に使用される 2 つの例です。これらには長所と短所があり、その適合性は特定の用途と要件によって異なります。