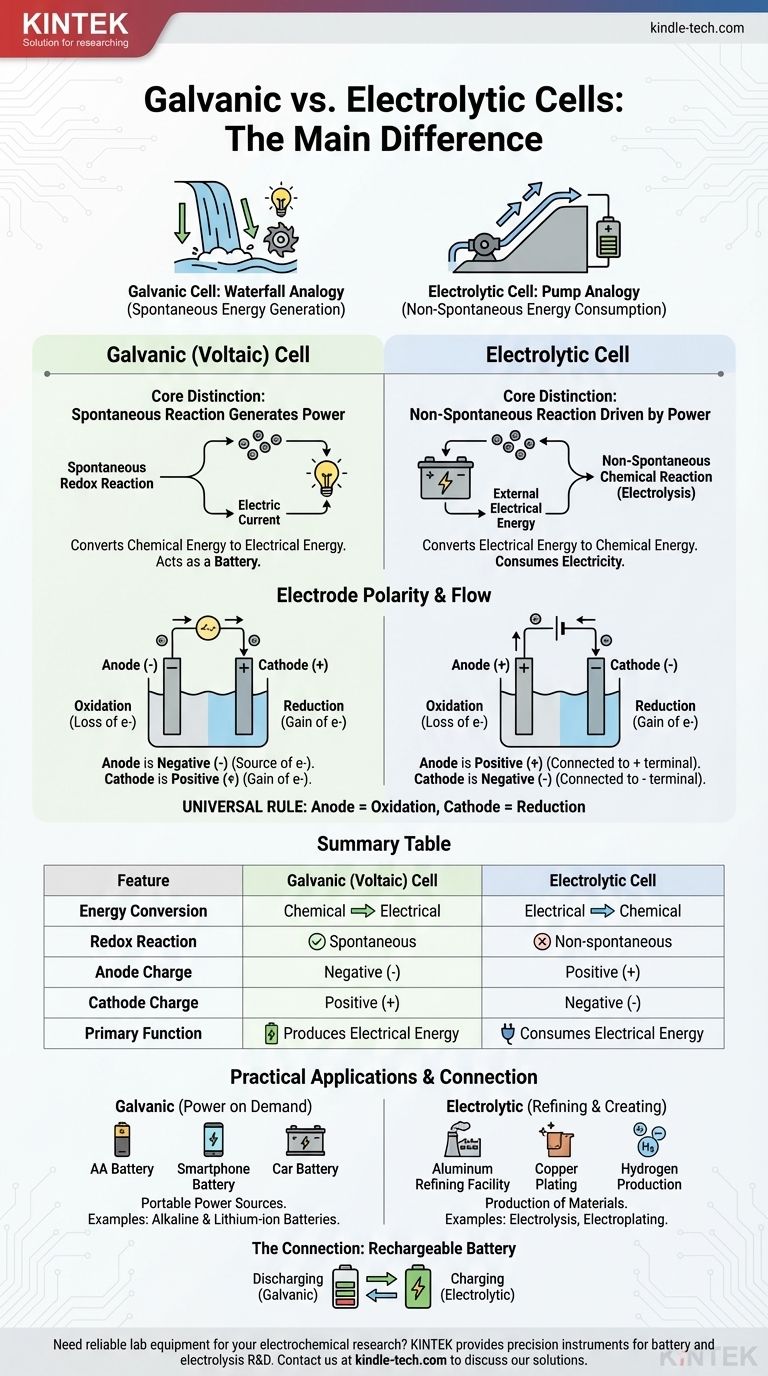
根本的な違いは、エネルギー変換の方向と化学反応の性質にあります。ガルバニ電池は、蓄えられた化学エネルギーを自発的に電気エネルギーに変換し、効果的にバッテリーとして機能します。対照的に、電気分解セルは外部の電力源を使用して、非自発的な化学反応を強制的に起こさせます。
これを、発電する滝と電力を使用するポンプの違いだと考えてください。ガルバニ電池は滝のようなもので、自然で自発的なプロセス(水が下流に流れること)がエネルギーを生み出します。電気分解セルはポンプのようなもので、外部エネルギーを使用して、それ自体では起こらないプロセス(水を押し上げて上流にやること)を強制的に行わせます。
核心的な違い:自発性とエネルギーの流れ
これら2つのセルの挙動は、内部の酸化還元反応が自然に起こるかどうかの1つの原理によって支配されています。
ガルバニ電池:電力を生成する自発的な反応
ボルタ電池とも呼ばれるガルバニ電池では、選択された化学反応物質には互いに反応する自然な傾向があります。
この自発的な酸化還元反応はエネルギーを放出します。セルは、このエネルギーを熱としてではなく、電子の整った流れ、つまり電流として誘導するように構築されています。
本質的に、ガルバニ電池は自然に起こる化学プロセスを利用して電気的な仕事をします。これがすべてのバッテリーの基礎となる原理です。
電気分解セル:電力によって駆動される非自発的な反応
電気分解セルでは、化学反応は非自発的です。反応物質は、目的の生成物を生成するために自然には相互作用しません。
反応を起こさせるために、外部電源(バッテリーや電源など)がセルに接続されます。この外部電圧は、電子を移動させ、化学変化を駆動するために必要なエネルギーを供給します。
電気分解セルは、電気を消費して化学生成物を作り出します。このプロセスは電気分解として知られています。

電極の極性に関する詳細
「アノード」と「カソード」という用語は一定ですが、その電荷(極性)は2つのセルタイプ間で逆転するため、混乱しやすい点です。重要なのは、電子の流れを駆動するものを記憶することです。
アノード:常に酸化の場
両方のセルタイプにおいて、アノードは酸化(電子の損失)が発生する電極として定義されます。この定義は普遍的です。
カソード:常に還元の場
同様に、カソードは常に還元(電子の獲得)が行われる電極です。これは2番目の普遍的な規則です。
決定的な変化:極性が変化する理由
極性の違いは、反応が自発的か強制的なものかに由来します。
ガルバニ電池では、アノードでの自発的な酸化が電子を放出し、負電荷を生成します。アノードは、回路内に電子を押し出す源であるため、負極になります。
電気分解セルでは、外部電源が使用されます。その正極はアノードから電子を「引き抜き」、酸化を強制します。したがって、アノードは正極側に接続され、正極になります。
| 特徴 | ガルバニ(ボルタ)セル | 電気分解セル |
|---|---|---|
| エネルギー変換 | 化学から電気へ | 電気から化学へ |
| 酸化還元反応 | 自発的 | 非自発的 |
| アノードの電荷 | 負(-) | 正(+) |
| カソードの電荷 | 正(+) | 負(-) |
| 主な機能 | 電気エネルギーを生成する | 電気エネルギーを消費する |
実用的な応用を理解する
この根本的な違いは、技術と産業において異なる用途につながります。
ガルバニ電池の動作:必要なときに電力を供給
ガルバニ電池は、携帯可能な電源として設計されています。一般的な例としては、標準的な単三アルカリ電池から携帯電話のリチウムイオン電池まで、あらゆる種類のバッテリーが挙げられます。
電気分解セルの動作:精製と創造
電気分解セルは、材料を生成するために電力を利用します。主要な産業プロセスは電気分解に依存しており、鉱石からの純粋なアルミニウムの生成、銅の精製、水を分解して水素と酸素ガスを生成することなどが含まれます。銀やクロムなどの金属の薄い層を別の物体に堆積させる電気めっきも、一般的な応用例です。
つながり:充電式バッテリーの仕組み
充電式バッテリーは、1つのデバイス内で両方のセルタイプを示す完璧な例です。
デバイスに電力を供給しているとき(放電中)、それはガルバニ電池として機能しています。バッテリー内部の自発的な化学反応が電流を生成します。
充電するためにプラグを差し込むとき、充電器は外部電源として機能します。それは電圧を印加し、非自発的な逆反応を強制的に起こさせ、反応物質を補充します。充電中、バッテリーは電気分解セルとして機能しています。
目的に合った選択をする
あなたの目的が、使用する電気化学的フレームワークを決定します。
- 化学プロセスから電力を生成することに主な焦点を当てている場合: あなたはガルバニ(ボルタ)電池について説明しています。
- 特定の化学変化を駆動するために電力を使用することに主な焦点を当てている場合: あなたは電気分解セルに取り組んでいます。
- 充電式バッテリーを分析している場合: 放電中はガルバニ電池として、充電中は電気分解セルとして機能することを覚えておいてください。
結局のところ、反応の自発性と結果として生じるエネルギーの流れの方向が、電気化学のこれら2つの柱を分ける決定的な特徴となります。
要約表:
| 特徴 | ガルバニ(ボルタ)セル | 電気分解セル |
|---|---|---|
| エネルギー変換 | 化学から電気へ | 電気から化学へ |
| 酸化還元反応 | 自発的 | 非自発的 |
| アノードの電荷 | 負(-) | 正(+) |
| カソードの電荷 | 正(+) | 負(-) |
| 主な機能 | 電気エネルギーを生成する | 電気エネルギーを消費する |
電気化学研究のための信頼できる実験装置が必要ですか?新しいバッテリー技術の開発であれ、電気分解プロセスの最適化であれ、KINTEKはあなたの研究室が必要とする精密機器と消耗品を提供します。当社のソリューションがあなたのイノベーションをどのように推進できるかについて、今すぐお問い合わせください!
ビジュアルガイド
関連製品
よくある質問
- 電解槽は使用後にどのように洗浄すべきですか?汚染を防ぐためのステップバイステップガイド
- 電着の利点は何ですか?複雑な形状に精密なコーティングを実現
- 3電極電解セルを使用する利点は何ですか?ステンレス鋼分析の精度を達成する
- コーティング評価用電解セルは、どのような電極システム向けに設計されていますか?精密なコーティング分析を可能にする
- ニッケル基超合金の回収において、隔膜電解槽はどのような役割を果たしますか?専門家の洞察
- PDPスキャンに高精度ポテンショスタットを使用する意義は何ですか?正確な腐食の洞察を解き明かす
- ゼロギャップ電解セルにおいて、PPS製織布セパレーターに要求される特定の機械的・物理的特性は何ですか?
- MCFCの分析に高温触媒反応セルが必要なのはなぜですか?燃料電池の性能を正確に確保する















