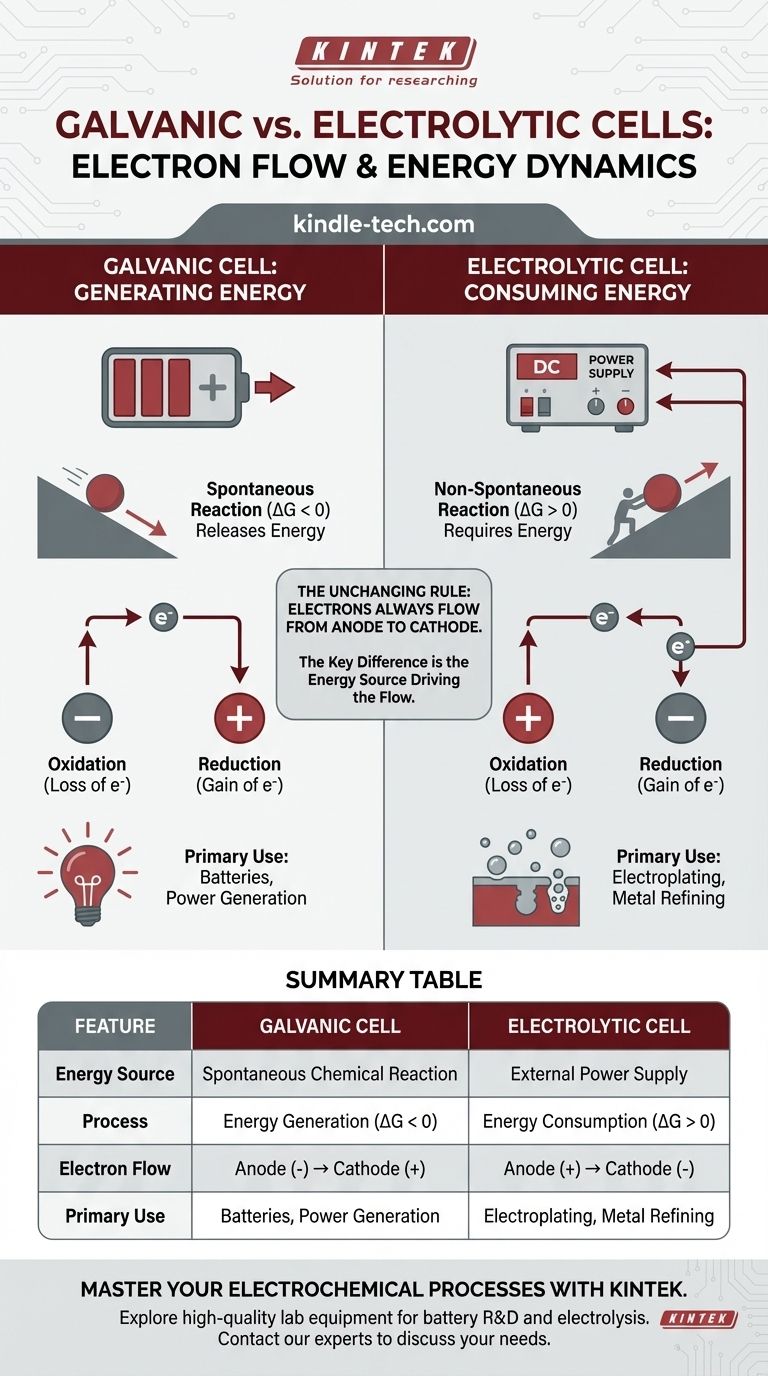
あらゆる電気化学セルにおいて、外部回路における電子の流れは常にアノードからカソードへと向かいます。決定的な違いは、それらが流れる理由にあります。ガルバニ電池では、自発的な化学反応がエネルギーを生成し、電子を押し出します。電解槽では、外部電源がエネルギーを供給し、電子を強制的に流して非自発的な反応を駆動します。
根本的な違いは、酸化と還元に対する電子の流れの方向ではなく、プロセスを駆動するエネルギー源です。ガルバニ電池は貯蔵された化学エネルギーを電気エネルギーに変換し、電解槽は外部の電気エネルギーを使用して化学変化を強制します。
核心原理:自発的反応と非自発的反応
電子の流れを理解するには、まずセルのエネルギーダイナミクスを理解する必要があります。システム全体は、化学反応が自然に起こるか、強制されるかによって支配されます。
ガルバニ電池:エネルギーの生成
ガルバニ電池(ボルタ電池とも呼ばれる)は、自発的な化学反応を利用します。これは、ボールが坂道を転がり落ちるように、プロセスが自然にエネルギーを放出すると考えてください。
この自発的な反応は負のギブズ自由エネルギー(ΔG < 0)を持ちます。この化学エネルギーの放出は電気エネルギーに直接変換され、アノードから外部回路を介してカソードへと電子を押し出します。
ガルバニ電池は、すべての従来の電池の基礎となっています。
電解槽:エネルギーの消費
電解槽は、非自発的な化学反応を駆動するために使用されます。これは、ボールを坂道に押し上げるように、反応が起こるためには常に外部からのエネルギー入力が必要です。
この反応は正のギブズ自由エネルギー(ΔG > 0)を持ちます。電池や電源のような外部電源が「電子ポンプ」として機能します。それは電子をカソードに強制的に送り込み、アノードから電子を引き離すことで、それ自体では起こらない反応を駆動します。

電子の流れと電極の極性の解体
電子の流れに関する混乱は、電極の極性が変化することに起因することがよくあります。アノードとカソードの役割は固定されていますが、その電荷は固定されていません。
不変の規則:アノードからカソードへ
定義上、酸化(電子の損失)が起こる場所は常にアノードであり、還元(電子の獲得)が起こる場所は常にカソードです。
電子はアノードで失われ、カソードで獲得されるため、外部ワイヤー内の電子は常にアノードからカソードへと流れます。これは両方のセルタイプに共通する普遍的な定数です。
決定的な違い:電極の電荷
電極の極性(正または負の電荷)は、2つのセルタイプ間で反転し、これがほとんどの混乱の原因です。
ガルバニ電池では、アノードは電子を放出する自発的な酸化の場所です。この負電荷の蓄積により、アノードは負極(-)になります。電子を消費するカソードは正極(+)になります。
電解槽では、外部電源が極性を決定します。外部電源は負極をセルのカソードに接続して電子を強制的に送り込み還元を駆動します。正極をセルのアノードに接続して電子を引き離し酸化を駆動します。
- ガルバニ電池:アノード(-)→カソード(+)
- 電解槽:アノード(+)→カソード(-)
実用的な応用を理解する
根本的な違いであるエネルギー変換は、これらのセルがどのように使用されるかを決定します。一方は電力を生成し、もう一方は貴重な材料を生成するために電力を消費します。
ガルバニ電池:オンデマンド電力
ガルバニ電池の主な利点は、携帯型電源として機能する能力です。
これらは、単純な単三電池から自動車のバッテリーまで、あらゆるバッテリーの基礎となっています。主な制限は、化学反応物質が最終的に消費され、電圧が低下してバッテリーが切れることです。
電解槽:化学変化の強制
電解槽の目的は、電気を使用して化学製品を作成することです。
電気分解として知られるこのプロセスは、金属の精錬(例:純アルミニウムの製造)、保護金属層による表面の電気めっき、水を水素と酸素に分解するなどの産業用途に不可欠です。欠点は、継続的でしばしば高価な電力供給が必要なことです。
これを目標に適用する方法
あなたのアプローチは、電気を生成する必要があるか、化学反応を駆動する必要があるかによって完全に異なります。
- 電力を生成したり、バッテリーを作成したりすることに主眼を置く場合:あなたは、自発的な反応が電流を生成するガルバニ電池を扱っています。
- 金属を精製したり、表面を電気めっきしたり、化合物を分解したりすることに主眼を置く場合:あなたは、外部電力を使用して非自発的な反応を駆動する電解槽が必要です。
- 核心原理を理解することに主眼を置く場合:酸化は常にアノードで、還元はカソードで起こることを忘れないでください。主な違いは、反応が自発的(ガルバニ)か、強制(電解)かです。
自発的なエネルギー放出と強制的なエネルギー入力のこの区別を理解することが、電気化学セルを習得するための鍵です。
要約表:
| 特徴 | ガルバニ電池 | 電解槽 |
|---|---|---|
| エネルギー源 | 自発的な化学反応 | 外部電源 |
| プロセス | エネルギー生成(ΔG < 0) | エネルギー消費(ΔG > 0) |
| 電子の流れ | アノード(-)→カソード(+) | アノード(+)→カソード(-) |
| 主な用途 | バッテリー、発電 | 電気めっき、金属精錬 |
KINTEKで電気化学プロセスをマスターしましょう
新しいバッテリー技術を開発している場合でも、電気分解によって材料を精製している場合でも、正確で信頼性の高い結果を得るためには適切な実験装置が不可欠です。KINTEKは高品質の実験装置と消耗品を専門とし、すべての電気化学の研究開発に必要な精密なツールを提供します。
あなたの研究室の成功を支援させてください。今すぐ専門家にお問い合わせください。具体的なニーズについて話し合い、KINTEKがあなたの画期的な研究をどのようにサポートできるかを発見してください。
ビジュアルガイド
関連製品
よくある質問
- 全PTFE電解セルを使用した実験中に考慮すべき運用上の注意点は何ですか?精度と安全性を確保してください。
- 実験中、5ポート水浴電解槽はどのように操作すべきですか?信頼性の高い結果を得るための精密な制御を習得する
- MECにおけるアップフロー内部循環リアクター設計の機能は何ですか?BTH分解効率の向上
- 電解槽の標準的な開口部仕様は何ですか?電気化学セットアップの主要サイズ
- アンモニア合成において、PEMを備えたH型リアクターが必要なのはなぜですか?窒素固定におけるデータ精度を確保する
- H型電解セルを使用する前に、どのような点検を行うべきですか?実験の安全性とデータの正確性を確保してください。
- 電解槽の故障はどのように対処すべきか?安全な診断と修理のためのガイド
- XAS電気化学セルにポリ(エテリ ルエーテルケトン)(PEEK)が選ばれる理由は何ですか?化学的安定性と精度を確保する



















