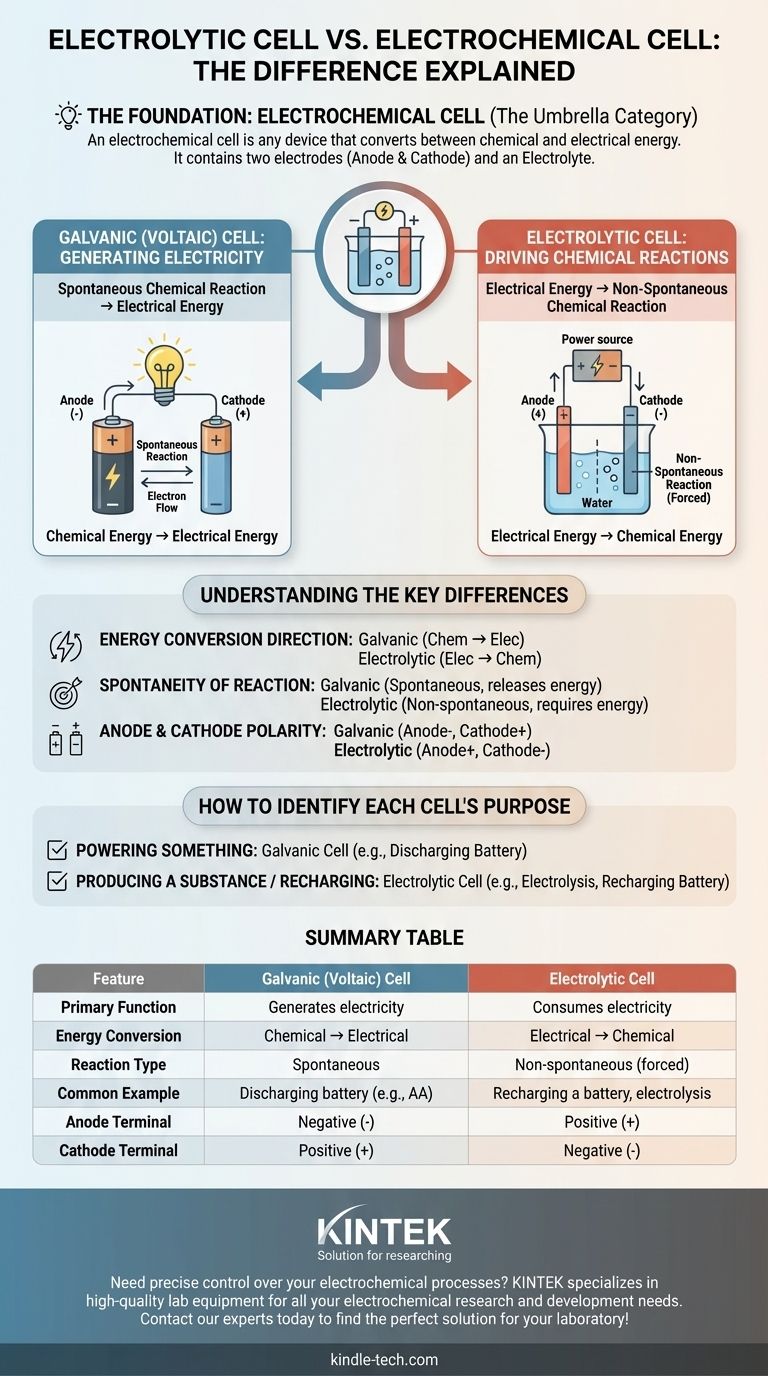
主な混乱の原因は、電解セルが電気化学セルとは別の概念ではないということです。それは電気化学セルの2つの主要なタイプの1つです。電気化学セルは、化学エネルギーと電気エネルギーの間で変換を行うあらゆる装置の広範なカテゴリです。本当の区別は、化学反応から電気を生成するガルバニ(ボルタ)電池と、電気を使って化学反応を起こす電解セルの間にあります。
電気化学セルという用語は包括的なカテゴリです。このカテゴリの下にある2つの特定のタイプは、ガルバニ電池(電気を生成するもの)と電解セル(電気を消費するもの)です。それらの根本的な違いは、エネルギー変換の方向です。
基本:電気化学セルとは?
主要な構成要素
電気化学セルは、2つの電極(アノードとカソード)と電解質を含むあらゆる装置です。これらの構成要素が連携して電子の移動を促進し、電流を生成または消費します。
包括的な目的
電気化学セルの唯一の目的は、化学エネルギーと電気エネルギーの間の架け橋となることです。このエネルギー変換の方向が、セルの特定のタイプを決定します。

2つの基本的な変換タイプ
ガルバニ(ボルタ)電池:電気の生成
ガルバニ電池は、ボルタ電池とも呼ばれ、自発的な化学反応を利用して電気エネルギーを生成します。
標準的な単三電池を考えてみてください。内部の化学物質が自然に反応し、装置に電力を供給できる電流の形でエネルギーを放出します。これがガルバニ電池の動作です。
電解セル:化学反応の駆動
電解セルは、その逆を行います。外部の電気エネルギー源(電源など)を使用して、非自発的な化学反応を強制的に起こさせます。
一般的な例は、水を水素と酸素に分解する電気分解です。この反応は自然には起こりません。絶えず電気の入力が必要であり、これが電解セルの機能です。バッテリーの充電もこのプロセスの別の例です。
主な違いの理解
エネルギー変換の方向
これが最も重要な区別です。ガルバニ電池は蓄えられた化学エネルギーを電気エネルギーに変換します。電解セルは供給された電気エネルギーを化学エネルギーに変換します。
反応の自発性
ガルバニ電池の化学反応は自発的であり、自然に進行し、エネルギーを放出します。
電解セルの反応は非自発的であり、進行させるには外部エネルギーの絶え間ない入力が必要です。
アノードとカソードの極性
これはよく混同される点ですが、エネルギーの流れから論理的に導き出されます。
ガルバニ電池(放電中のバッテリー)では、アノードは電子の供給源であり、負の端子となり、カソードは正の端子です。
電解セル(充電中のバッテリー)では、外部電源が流れを逆転させます。アノードでは依然として酸化が起こりますが、強制的に正の端子となり、カソードは負の端子になります。
各セルの目的を識別する方法
セルの主な機能を手がかりに、2つのタイプを簡単に区別してください。
- 主な目的が何かを動かすことである場合:自発的な化学反応が電気を生成しているため、ガルバニ(ボルタ)電池を使用しています。
- 主な目的が物質を生成すること、またはバッテリーを充電することである場合:電気が化学反応を強制するために消費されているため、電解セルを使用しています。
最終的に、どちらも同じ電気化学のコインの裏表であり、電気を生成するか消費するかによって定義されます。
要約表:
| 特徴 | ガルバニ(ボルタ)電池 | 電解セル |
|---|---|---|
| 主な機能 | 電気を生成する | 電気を消費する |
| エネルギー変換 | 化学 → 電気 | 電気 → 化学 |
| 反応の種類 | 自発的 | 非自発的(強制) |
| 一般的な例 | 放電中のバッテリー(例:単三電池) | バッテリーの充電、電気分解 |
| アノード端子 | 負(-) | 正(+) |
| カソード端子 | 正(+) | 負(-) |
電気化学プロセスを正確に制御する必要がありますか? KINTEKは、あらゆる電気化学の研究開発ニーズに対応する高品質の実験装置を専門としています。新しいバッテリー技術の開発や電気分解による材料合成など、当社の信頼性の高い機器は正確で再現性のある結果を保証します。今すぐ専門家にお問い合わせください。お客様のラボに最適なソリューションを見つけます!
ビジュアルガイド