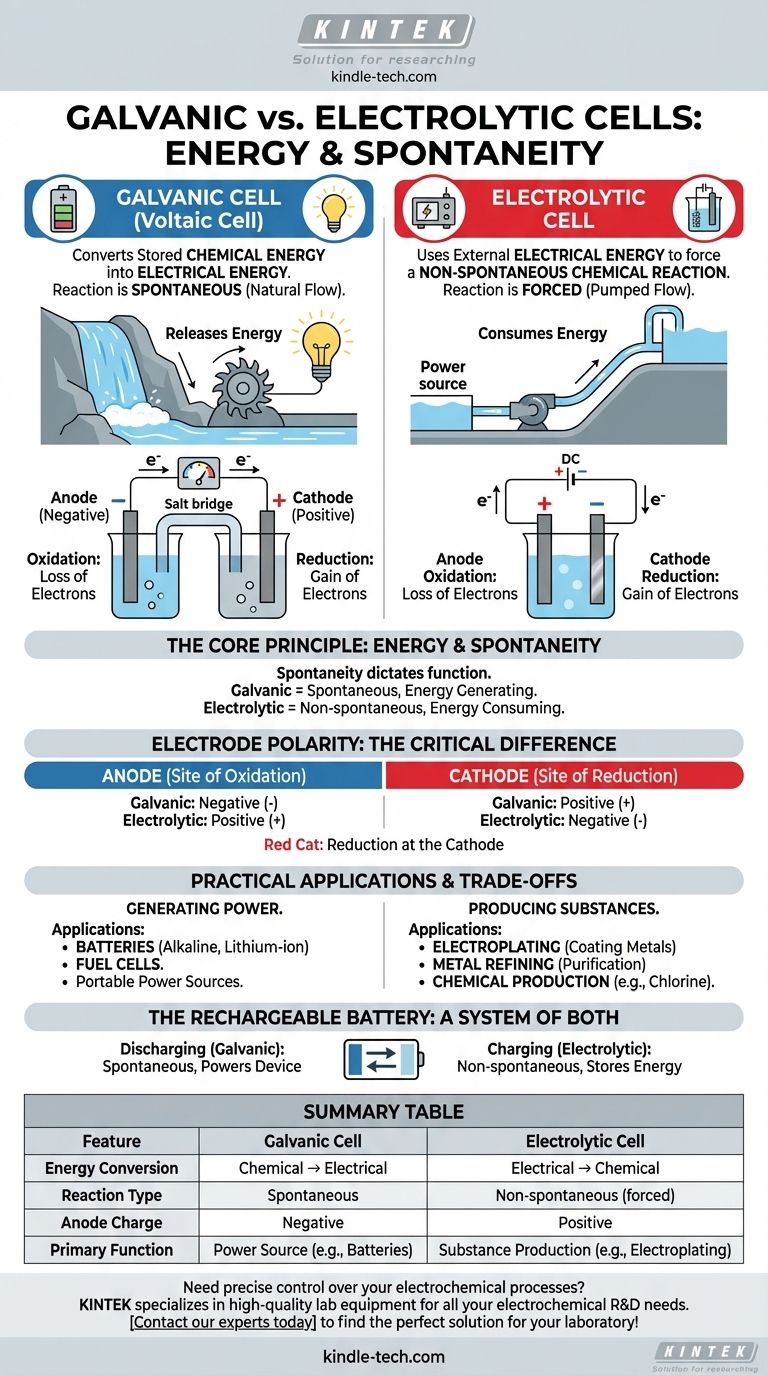
本質的に、ガルバニ電池と電気分解セルの違いは、エネルギー変換の方向です。ガルバニ電池(またはボルタ電池)は、デバイスに電力を供給するバッテリーのように、自発的な反応を通じて蓄えられた化学エネルギーを電気エネルギーに変換します。対照的に、電気分解セルは外部の電気エネルギーを使用して、金属めっきのように、非自発的な化学反応を強制的に起こさせます。
根本的な区別は自発性にあります。ガルバニ電池は、自発的に起こり、エネルギーを電気として放出する化学反応を利用します。電気分解セルは、そうでない化学反応を強制的に起こさせるために電気を使用します。
核心原理:エネルギーと自発性
すべての電気化学セルの挙動は、内部の酸化還元反応が自発的か非自発的かによって決定されます。この単一の原理が、その機能と構造を決定します。
ガルバニ電池:エネルギーの生成
ガルバニ電池では、化学反応は自発的です。これは、反応物のポテンシャルエネルギーが生成物よりも高く、反応が自然に進み、エネルギーが放出されることを意味します。
この放出されたエネルギーが電子を外部回路に送り、電流を生成します。これは滝のようなものです。水は自然に下向きに流れ、その経路にタービンを設置して電気を生成することができます。
電気分解セル:エネルギーの消費
電気分解セルでは、目的の化学反応は非自発的です。生成物は反応物よりも高いエネルギー状態にあるため、反応は自然には起こりません。
反応を起こさせるためには、外部電源(バッテリーや電源など)からエネルギーを供給する必要があります。この外部電圧は、電子を自然な方向とは逆に動かすように強制し、反応を駆動します。これは、ポンプを使って水を上方に押し上げるのに似ています。

この原理がセルの構成要素を定義する方法
アノードとカソードの基本的な定義は同じままですが、両方のセルタイプ間でその電荷(極性)が反転します。これは一般的な混乱点ですが、自発性の直接的な結果です。
アノード:常に酸化の場
両方のセルタイプにおいて、アノードは酸化(電子の損失)が発生する電極として定義されます。
カソード:常に還元の場
同様に、両方のセルタイプにおいて、カソードは還元(電子の獲得)が発生する電極です。「Red Cat」(カソードでの還元)という簡単な覚え方があります。
決定的な違い:電極の極性
ガルバニ電池では、アノードでの自発的な酸化が電子の流れを放出します。この負電荷の蓄積により、アノードは負になり、電子を引き付けるカソードは正になります。
電気分解セルでは、外部電源が使用されます。その正極はアノードに接続され、そこから化学種から強制的に電子を引き抜き、酸化を引き起こします。したがって、アノードは正になり、カソードは負になります。
実用的な応用とトレードオフ
エネルギーの生成と消費の違いは、これら2種類のセルで全く異なる現実世界の応用につながります。
実用的なガルバニ電池:ポータブル電源
ガルバニ電池は電源として設計されています。主な用途はバッテリーであり、使い捨てのアルカリ電池から携帯電話や車載の充電式リチウムイオンセルまで多岐にわたります。
燃料電池も別の種類のガルバニ電池であり、燃料(水素など)が供給されている限り、継続的に電力を生成します。
実用的な電気分解セル:製造と精製
電気分解セルは、材料を生産するために使用される産業の主力です。主な用途には、電気めっき(物体を薄い金属層でコーティングすること)や、銅やアルミニウムなどの金属の精製が含まれます。
また、海水(ブライン)から塩素ガスや水酸化ナトリウムなどの主要な工業用化学物質を生産するためにも不可欠です。
充電式バッテリー:両方のシステムの例
充電式バッテリーは、両方の原理を完璧に示す例です。デバイスに電力を供給しているときは、ガルバニ電池として機能し、自発的な反応を進行させます。充電するためにプラグを差し込むと、外部電源がプロセスを逆転させ、それを電気分解セルに変えて非自発的な反応を駆動し、初期の反応物を回復させます。
目標に合わせた適切な選択
どのセルを検討すべきかの理解は、エネルギーを生成したいのか、物質を生成したいのかによって完全に異なります。
- 化学反応から電力を生成することが主な焦点である場合: 自発的なプロセスが電流を生成するガルバニ電池を扱っています。
- 電気を使用して物質を生成することが主な焦点である場合: 外部電圧が非自発的な化学変化を駆動する電気分解セルを使用しています。
- 電気エネルギーの貯蔵と再利用が主な焦点である場合: 電気分解セル(充電時)とガルバニ電池(放電時)の間で切り替わる充電式システムを扱っています。
結局のところ、これら2種類のセルは、エネルギーの流れの方向によって定義される、同じ電気化学的なコインの裏表なのです。
要約表:
| 特徴 | ガルバニ電池 | 電気分解セル |
|---|---|---|
| エネルギー変換 | 化学 → 電気 | 電気 → 化学 |
| 反応タイプ | 自発的 | 非自発的(強制) |
| アノードの電荷 | 負 | 正 |
| 主な機能 | 電源(例:バッテリー) | 物質生産(例:電気めっき) |
電気化学プロセスを正確に制御する必要がありますか? 新しいバッテリー材料の開発であれ、金属めっき技術の改良であれ、正確な結果を得るためには適切な実験装置が不可欠です。KINTEKは、すべての電気化学研究開発ニーズに対応する高品質な実験装置と消耗品を専門としています。当社の専門家に今すぐお問い合わせ、お客様の研究室に最適なソリューションを見つけてください!
ビジュアルガイド