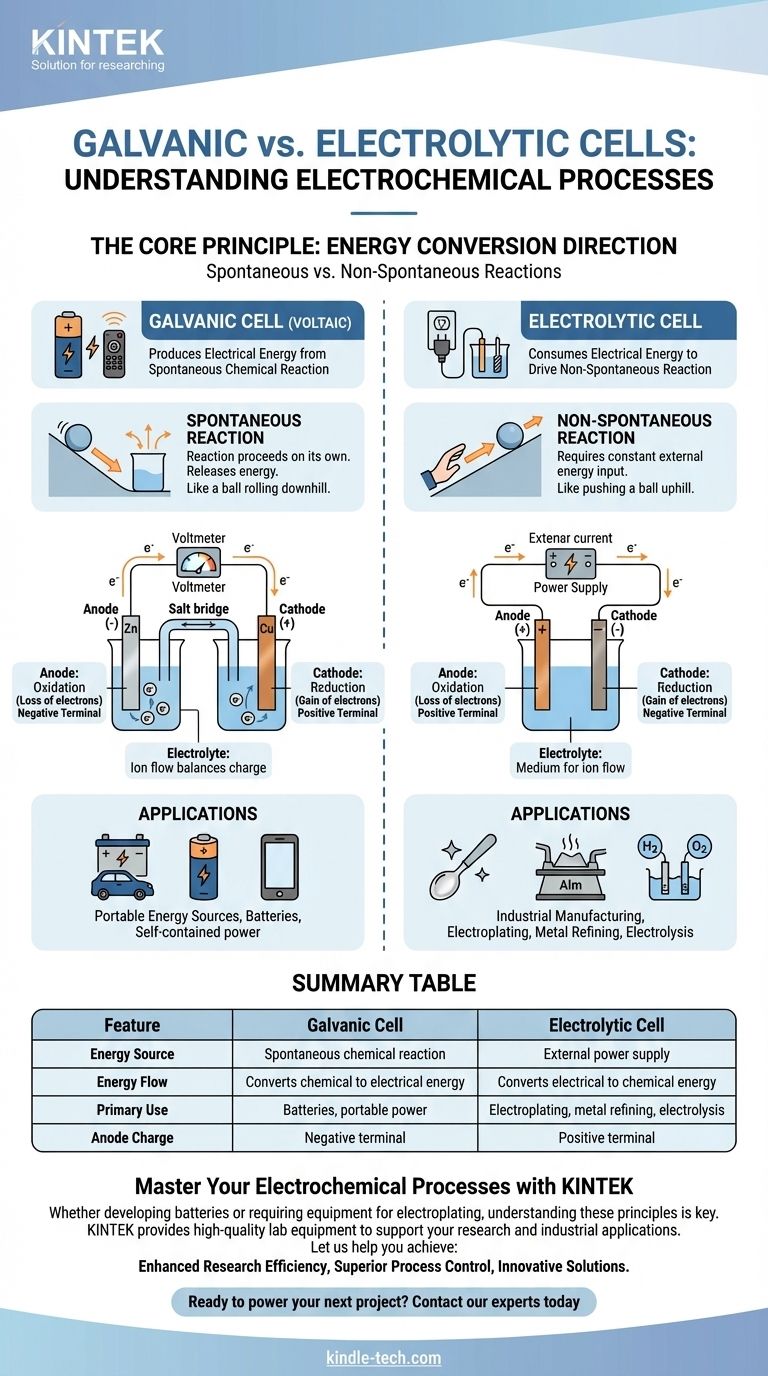
その核心において、ガルバニ電池は、リモコンを動かすバッテリーのように、自発的な化学反応から電気エネルギーを生成する電気化学電池です。対照的に、電解槽は、金属めっきや精製に使用されるプロセスで、非自発的な化学反応を強制的に起こさせるために、外部電源から電気エネルギーを消費します。
根本的な違いは、エネルギー変換の方向です。ガルバニ電池は貯蔵された化学エネルギーを電気エネルギーに変換し、電解槽は外部の電気エネルギーを化学エネルギーに変換します。
核心原理:自発的反応 vs. 非自発的反応
あらゆる電気化学電池の挙動は、その化学反応の自然な傾向によって決定されます。この傾向が、なぜ一方の電池が電力を生成し、もう一方が電力を必要とするのかを理解する鍵となります。
ガルバニ電池が電力を生成する方法
ボルタ電池としても知られるガルバニ電池は、自発的な化学反応を中心に構築されています。
これは、外部からの介入なしに自力で進行し、その過程でエネルギーを放出する反応です。坂道を転がり落ちるボールを想像してください。
このエネルギーの放出が電子を外部回路に押し出し、電流を生成します。これは、すべての非充電式バッテリーおよび放電中の充電式バッテリーの原理です。
電解槽が電力を消費する方法
電解槽は非自発的な化学反応を駆動します。
これは、自力では起こらず、進行するために継続的なエネルギー入力が必要な反応です。これは、ボールを上り坂に押し上げることに相当します。
電源などの外部電源が、電子を自然な流れに逆らって強制的に流し、望ましい化学変化を駆動するために必要な電圧を供給します。

電池機能の実践的な側面
その目的は正反対ですが、両方の電池は、化学の同じ基本的な規則の下で動作する共通の構成要素を共有していますが、極性に決定的な違いがあります。
アノードとカソード:2つの極性の物語
両方の電池タイプにおいて、アノードは常に酸化(電子の損失)が起こる場所であり、カソードは還元(電子の獲得)が起こる場所です。
しかし、それらの電極の電荷は逆になります。ガルバニ電池では、自発的な反応がそこから電子を放出するため、アノードは負極です。
電解槽では、外部電源がそこから電子を引き離し、酸化を強制的に起こさせるため、アノードは正極です。
電解質の役割
両方の電池には、通常イオンを含む溶液である電解質が含まれています。
この媒体は、電気回路を完成させるために不可欠です。電子が外部ワイヤーを通って流れる間、イオンは電解質を通って流れ、電極での電荷を平衡させます。
用途とトレードオフの理解
これらの電池の対照的な機能は、大きく異なる現実世界の用途と固有の限界につながります。
ガルバニ電池:ポータブルエネルギー源
ガルバニ電池の主な用途は、バッテリーとして機能することです。それらは、ポータブルで自己完結型の電力源を提供します。
トレードオフは、電池内の化学反応物質が有限であることです。一度消費されると、電池は電力の生成を停止し、廃棄するか充電する必要があります。
電解槽:工業生産と精製
電解槽は、他の方法では化学的に不可能または非効率なプロセスに使用される、産業の主力製品です。
主な用途には、電気めっき(ある金属を別の金属でコーティングする)、アルミニウムや銅などの金属の精製、水からの水素と酸素の生成のための電気分解などがあります。その主な限界は、外部電気エネルギーの重要かつ継続的な供給が必要であることです。
この知識を適用する方法
これらの概念のどちらを選択するかは、電力を生成することが目標なのか、それとも化学変化を誘発することが目標なのかに完全に依存します。
- 化学反応から電気を生成することに主な焦点を当てる場合: バッテリーの設計や理解など、ガルバニ電池の原理に取り組んでいます。
- 電気を使用して製品を作成したり、物質を精製したりすることに主な焦点を当てる場合: 化学製造や冶金で一般的な電解槽の原理に取り組んでいます。
この区分を理解することが、電気化学の実践的な応用を習得するための第一歩です。
要約表:
| 特徴 | ガルバニ電池 | 電解槽 |
|---|---|---|
| エネルギー源 | 自発的な化学反応 | 外部電源 |
| エネルギーの流れ | 化学エネルギーを電気エネルギーに変換 | 電気エネルギーを化学エネルギーに変換 |
| 主な用途 | バッテリー、ポータブル電源 | 電気めっき、金属精製、電気分解 |
| アノードの電荷 | 負極 | 正極 |
KINTEKで電気化学プロセスをマスターする
新しいバッテリー技術を開発している場合でも、電気めっきや金属精製に正確な機器が必要な場合でも、これらのコアとなる電気化学原理を理解することは始まりにすぎません。KINTEKは、お客様の研究および産業用途をサポートするために、高品質の実験装置と消耗品を提供することに特化しています。
私たちは、お客様が以下を達成するお手伝いをします。
- 研究効率の向上: ガルバニシステムと電解システムの両方のテストと開発のための信頼性の高い機器を提供します。
- 優れたプロセス制御: 電気めっき、電気分解、材料合成における一貫した結果のために。
- 革新的なソリューション: 研究室や生産施設の独自のニーズに合わせて調整します。
次のプロジェクトを推進する準備はできていますか? 今すぐ専門家にお問い合わせください。お客様の実験室のニーズに最適なソリューションを見つけます!
ビジュアルガイド