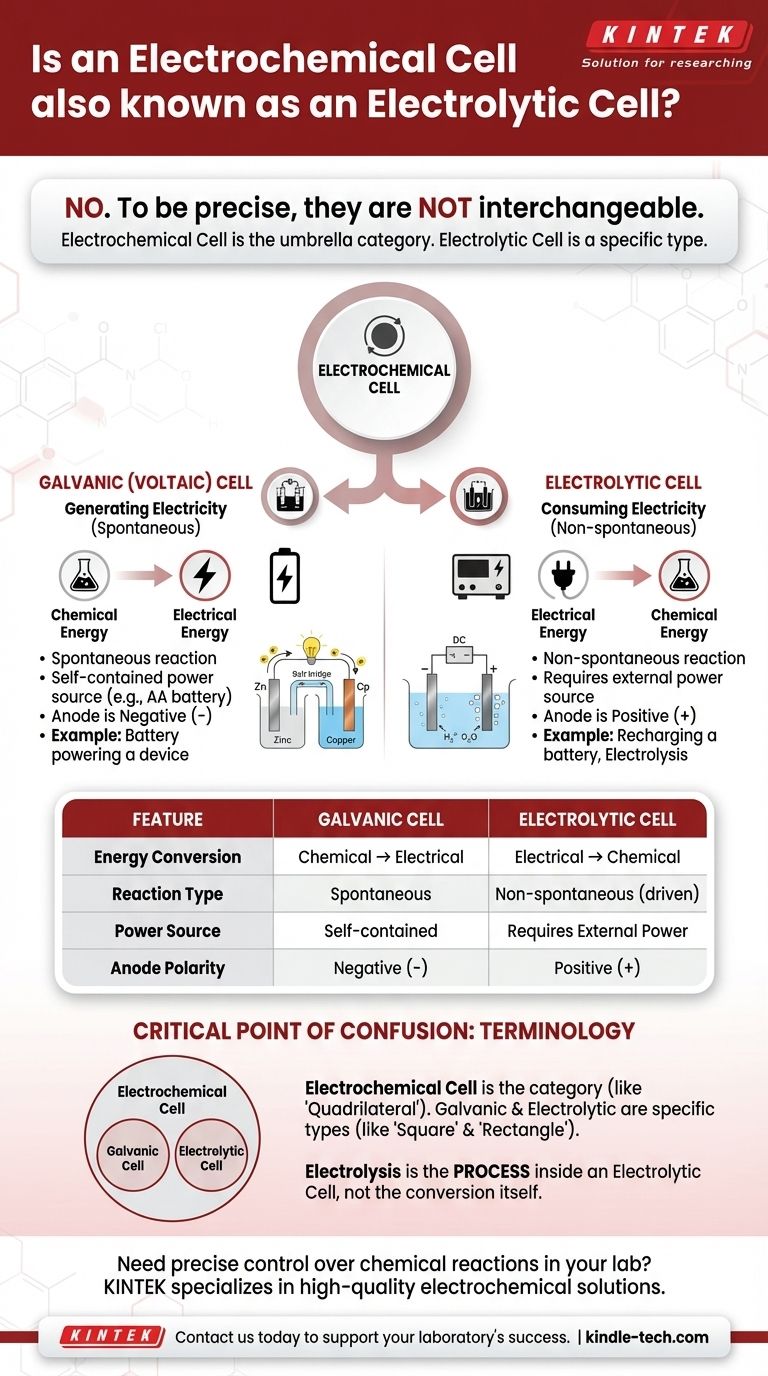
正確に言えば、いいえ。電解セルは電気化学セルの特定の種類ですが、この2つの用語は互換性がありません。「電気化学セル」は、化学エネルギーを電気エネルギーに変換したり、その逆を行ったりするあらゆる装置を指す広範な包括的なカテゴリです。電解セルは、特に電気エネルギーを使用して化学反応を引き起こす種類のものです。
核となる区別は、エネルギー変換の方向性にあります。ガルバニ電池(またはボルタ電池)は、化学反応から自発的にエネルギーを放出して電気を生成します。電解セルは、外部電源から電気を消費して化学反応を強制的に起こさせます。
根本的な区別:エネルギーの流れ
電気化学セルの目的によって、その分類が決まります。最初に問うべきは、そのセルがエネルギーを生成しているのか、消費しているのかということです。
ガルバニ電池(ボルタ電池):電気の生成
ガルバニ電池は、ボルタ電池とも呼ばれ、自発的な化学反応を利用します。
セル内の反応物質は、反応する自然な傾向があり、その過程でエネルギーを放出します。このエネルギーは電流として捕捉されます。
リモコンに入っている標準的な単三電池を考えてみてください。これはガルバニ電池であり、内部の化学エネルギーをリモコンを動かすのに必要な電気エネルギーに変換しています。
電解セル:電気の消費
電解セルは、外部の電気エネルギー源(電源など)を使用して、非自発的な化学反応を駆動します。
この外部電源がなければ、化学反応は自然には起こりません。電気は、その自然な傾向に逆らって反応を進行させます。
一般的な例としては、水を水素と酸素ガスに分解する電気分解があります。また、リチウムイオン電池の充電もそうです。電気を使って放電反応を逆転させ、化学ポテンシャルを回復させています。

各セルタイプの主要な識別子
エネルギーの流れの方向性以外にも、いくつかの技術的な特徴が2つのセルタイプを区別するのに役立ちます。
外部電源の役割
これが最も分かりやすい指標です。デバイスが自己完結型で電源として機能している場合、それはガルバニ電池です。
デバイスが機能するために外部電源に接続する必要がある場合、それは電解セルです。
アノードとカソードの極性
アノード(酸化が起こる場所)とカソード(還元が起こる場所)の定義は一定ですが、それらの電気的電荷(極性)は2つのセルタイプ間で反転します。
ガルバニ電池では、アノードは負極(-)端子、カソードは正極(+)端子です。
電解セルでは、外部電源がこれを逆転させます。アノードは正極(+)端子になり、カソードは負極(-)端子になります。
混乱の重要な点:用語
混乱の主な原因は、用語が重複しているが異なる性質を持っていることに起因します。それらを区別できないと、根本的な誤解につながります。
「電気化学セル」は包括的な用語
「電気化学セル」を「四角形」のような一般的なカテゴリと考えてください。
ガルバニ電池と電解セルは、そのカテゴリ内の特定のタイプであり、「正方形」と「長方形」が四角形の特定のタイプであるのと似ています。電解セルは常に電気化学セルですが、すべての電気化学セルが電解セルであるわけではありません。
「電気分解」の誤用
電気分解は、電気を使用して化学反応を駆動するプロセスです。このプロセスは、電解セル内で行われます。
一部の定義では、電気分解を化学エネルギーから電気エネルギーへの変換と誤って記述しています。これは真実とは逆です。電気分解は、根本的に電気を使用して化学変化を引き起こすことです。
目的に合った適切な区別をする
この知識を正しく適用するには、分析しているデバイスの主要な機能を特定するだけです。
- 何か(リモコン、電話、時計)に電力を供給しているデバイスに焦点を当てている場合:あなたはガルバニ電池(ボルタ電池)を扱っており、これは蓄えられた化学エネルギーを電気に変換します。
- 電気を使用して物質を生成するプロセス(バッテリーの充電、金属のめっき、塩素ガスの生成)に焦点を当てている場合:あなたは電解セルを扱っており、これは電気エネルギーを使用して化学変化を強制します。
- 一般的な分野や、充電式バッテリーのように二重の機能を備えたデバイスについて説明している場合:「電気化学セル」という用語が正しく、最も包括的な選択肢です。
エネルギー変換の方向性を理解することが、化学と工学におけるこの基本的な概念を習得するための鍵です。
要約表:
| 特徴 | ガルバニ電池(ボルタ電池) | 電解セル |
|---|---|---|
| エネルギー変換 | 化学 → 電気 | 電気 → 化学 |
| 反応タイプ | 自発的 | 非自発的(駆動される) |
| 電源 | 自己完結型(例:電池) | 外部電源が必要 |
| アノード極性 | 負極(-)端子 | 正極(+)端子 |
| 一般的な例 | リモコンの単三電池 | リチウムイオン電池の充電 |
研究室での化学反応を正確に制御する必要がありますか?適切な種類の電気化学セルを理解することは、研究とプロセスにとって非常に重要です。KINTEKでは、お客様の特定の電気化学的ニーズに合わせた高品質の実験装置と消耗品の提供を専門としています。エネルギー生成のためのガルバニ電池や合成のための電解セルを扱っている場合でも、当社のソリューションは精度と信頼性を保証します。今すぐお問い合わせください。お客様の研究室の成功をどのようにサポートできるかご相談ください!
ビジュアルガイド
関連製品
よくある質問
- 薄層分光電気化学セルを使用する際に、どのような一般的な予防措置を講じるべきですか?正確な結果と機器の安全性を確保するために
- 多機能電気分解セルにはどのような種類の電極が使用されていますか?精密測定のための三電極システムをマスターする
- マイクロ電気化学セルシステムを使用する利点は何ですか?Mg-Ag合金特性評価の最適化
- 実験後の電解液はどのように処理すべきか?安全で法令順守した廃棄方法のガイド
- 単一粒子の電気化学的固定具は、固定床内の個々の粒子の性能分析にどのように役立ちますか?正確な粒子インサイトを解き明かす
- ガラス製電解セルに関する一般的な取り扱い上の注意点は何ですか?投資を保護し、信頼性の高い結果を確保しましょう
- 電気凝固に耐酸性、飛散防止性、透明な素材を使用する理由とは?リアクターの安全性と視認性を向上させる
- 石英窓付き電解セルの要件は何ですか?正確なPEC性能テストを保証する



















