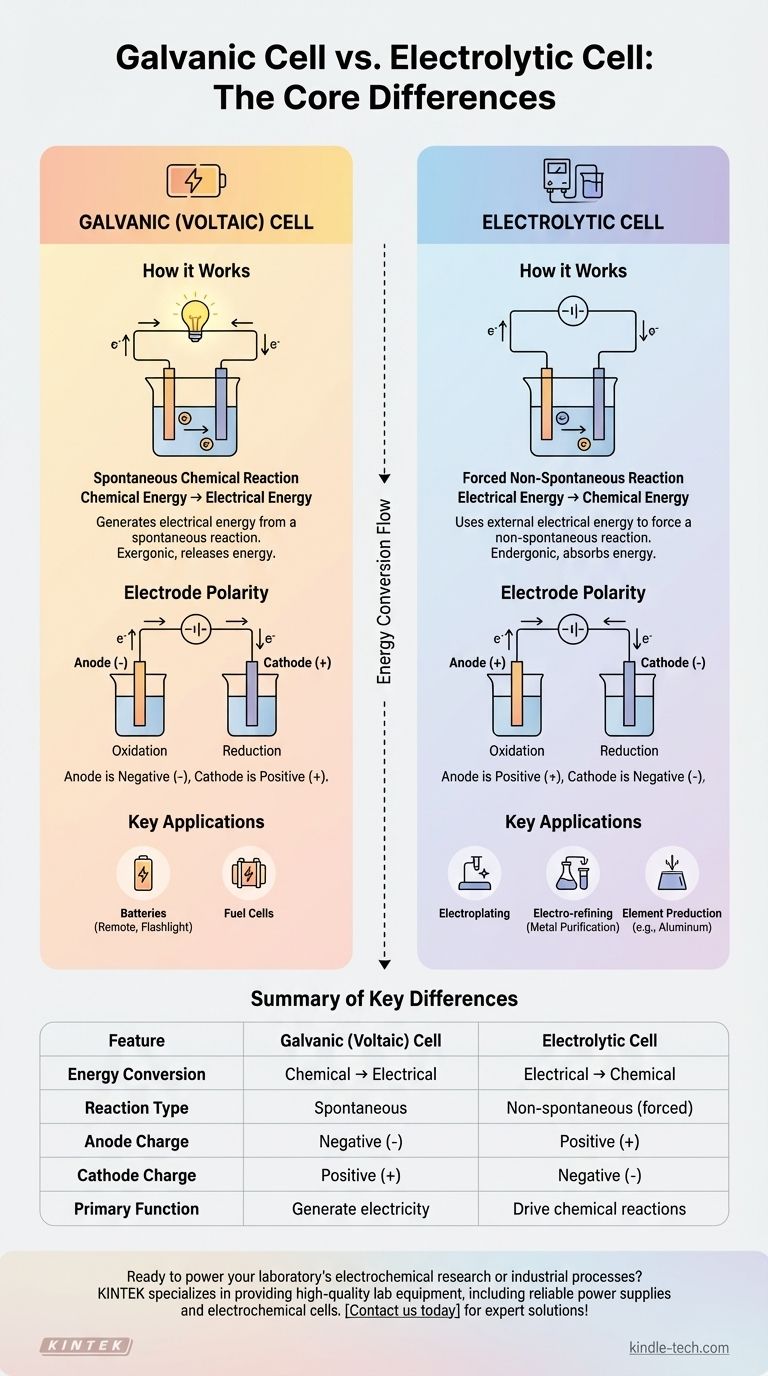
ご質問では2つの電解槽について言及されていますが、電気化学における核心的な区別は、電解槽とガルバニ電池(ボルタ電池とも呼ばれる)の間にあります。ガルバニ電池は、一般的な電池のように、自発的な化学反応から電気エネルギーを生成します。対照的に、電解槽は、外部の電気エネルギー源を使用して、非自発的な化学反応を強制的に起こさせます。
根本的な違いはエネルギー変換にあります。ガルバニ電池は貯蔵された化学エネルギーを電気エネルギーに変換しますが、電解槽はその逆で、電気エネルギーを化学エネルギーに変換して目的の物質を生成します。
ガルバニ電池(ボルタ電池)の仕組み
ガルバニ電池は、電気を生成する自己完結型のシステムです。リモコンや懐中電灯で使用する標準的な電池を思い浮かべてください。
自発的な化学反応
ガルバニ電池の原動力は、自発的な酸化還元(レドックス)反応です。これは、外部からのエネルギー入力なしに化学反応が自然に発生し、その過程でエネルギーを放出することを意味します。
エネルギー変換:化学エネルギーから電気エネルギーへ
自発的な反応によって放出されたエネルギーは、外部回路を通して電子を押し出し、電流を生成します。これにより、貯蔵された化学ポテンシャルエネルギーが利用可能な電気エネルギーに効果的に変換されます。
電極の極性
ガルバニ電池では、アノードは酸化が起こる負極であり、カソードは還元が起こる正極です。電子は負のアノードから正のカソードへと流れます。

電解槽の仕組み
電解槽は、それ自体では起こらない化学変化を促進するために使用されます。このプロセスは電気分解として知られています。
非自発的な反応を強制する
これらのセルは、非自発的な反応を進行させるように設計されています。例えば、水は自発的に水素と酸素に分解されません。分解させるにはエネルギーが必要です。
外部電源の役割
この反応を促進するには、電解槽を電池やDC電源のような外部電源に接続する必要があります。この電源は、反応の自然な抵抗を克服するために必要なエネルギーを供給します。
電解質の機能
セルには電解質が含まれており、通常は溶融塩または塩溶液です。この物質には、電極に引き寄せられる移動可能なイオンが含まれており、化学反応を可能にし、電気回路を完成させます。
産業における応用
このプロセスは、電気めっき(物体を薄い金属層でコーティングする)、銅などの金属を精製するための電解精錬、ボーキサイト鉱石からアルミニウムなどの純粋な元素を製造するなど、多くの産業用途で重要です。
核心的な違いの理解
これら2つのセルを並べて比較すると、その対照的な性質が明らかになります。これらは同じ電気化学的コインの裏表です。
エネルギーの流れと自発性
ガルバニ電池は発エルゴン性であり、自発的な反応からエネルギーを放出します。電解槽は吸エルゴン性であり、非自発的な反応を促進するためにエネルギーを吸収します。
電極の極性の反転
これは重要な区別点です。酸化は常にアノードで、還元は常にカソードで起こりますが、それらの電荷は逆になります。
- ガルバニ電池の場合:アノードは負極(-)、カソードは正極(+)。
- 電解槽の場合:アノードは正極(+)、カソードは負極(-)。
この反転は、電解槽の外部電源が電子の流れを決定し、化学システムの自然な傾向を上書きするために起こります。
目的に合った選択をする
どちらのセルを使用するかは、電力を生成することが目的か、化学製品を生成することが目的かによって完全に異なります。
- 化学プロセスから電力を生成することが主な焦点である場合:これはガルバニ電池(ボルタ電池)を表しており、すべての電池の原理です。
- 電力を使用して物質を生成することが主な焦点である場合:電解槽が必要です。これは、産業用電気めっき、精錬、元素生産の基礎となります。
- 基本的な電気化学を理解することが主な焦点である場合:ガルバニ電池は自発的にエネルギーを放出し、電解槽は反応を強制するためにエネルギーを必要とすることを覚えておいてください。
最終的に、エネルギー変換の方向性が、これら2つの基本的な電気化学セルを定義し、区別する最も重要な要素です。
まとめ表:
| 特徴 | ガルバニ電池(ボルタ電池) | 電解槽 |
|---|---|---|
| エネルギー変換 | 化学 → 電気 | 電気 → 化学 |
| 反応の種類 | 自発的 | 非自発的(強制) |
| アノードの電荷 | 負極(-) | 正極(+) |
| カソードの電荷 | 正極(+) | 負極(-) |
| 主な機能 | 電気を生成(例:電池) | 化学反応を促進(例:電気めっき、精錬) |
研究室の電気化学研究や産業プロセスを強化する準備はできていますか? KINTEKは、信頼性の高い電源や特定のニーズに合わせた電気化学セルを含む、高品質の実験装置と消耗品を提供することに特化しています。新しい電池技術の開発や電気めっきシステムの最適化など、当社の専門知識は成功のための適切なツールを保証します。今すぐお問い合わせください。精密機器と専門的なソリューションでプロジェクトをどのようにサポートできるかご相談ください!
ビジュアルガイド
関連製品
よくある質問
- 電解槽のガラス部品を適切に扱う方法は何ですか?安全で正確な実験を確保するために
- XAS電気化学セルにポリ(エテリ ルエーテルケトン)(PEEK)が選ばれる理由は何ですか?化学的安定性と精度を確保する
- 電解濃縮セルのメカニズムとは?精密な実験室分析のためのトリチウム濃縮をマスターする
- 電気化学電池における腐食とは何か?金属劣化の4つの要素を理解する
- ガス状バイオマスにPEMリアクターを使用する技術的な利点は何ですか?安定性と純度の向上
- 工業用電解槽の冷却システムが不可欠な理由は何ですか?ピークパフォーマンスのための廃熱管理
- 回転鍛造されたCr-Ni-Ti鋼の分析において、電解エッチングセルはどのような役割を果たしますか?隠された微細構造を明らかにします。
- 電極とイオン交換膜の取り付け手順は何ですか?信頼性の高い電気化学セル組み立てのためのステップバイステップガイド



















