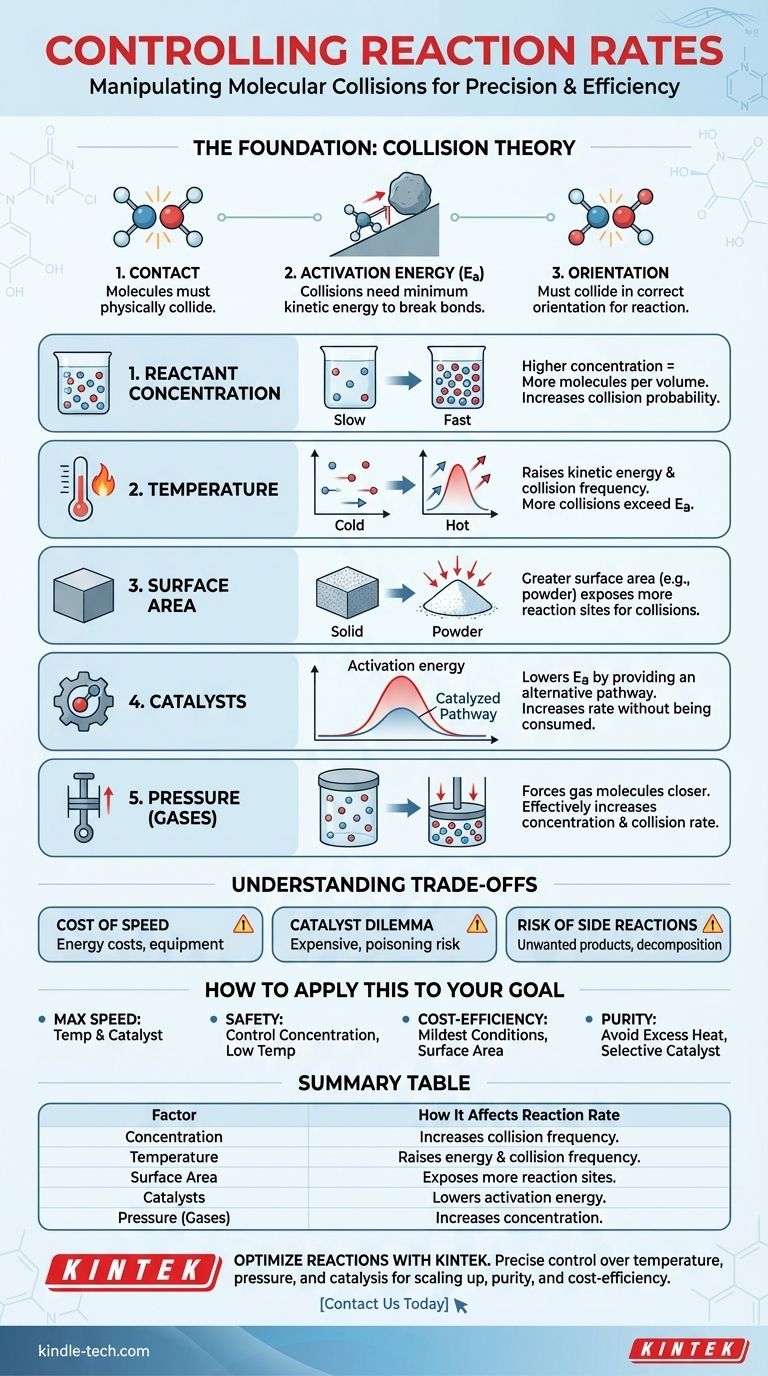
本質的に、化学反応の速度を制御する主要な要因は5つあります。反応物の濃度、温度、反応物の物理的状態と表面積、触媒の存在、そして気体の場合は圧力です。これらの要因はすべて、分子衝突の頻度とエネルギーに影響を与え、これがすべての化学変化の基本的な駆動力となります。
あらゆる化学反応の速度は、反応物分子が正しい配向で、かつ反応の活性化エネルギー障壁を乗り越えるのに十分なエネルギーをもって衝突する頻度によって決定されます。反応速度を制御するものはすべて、これらの衝突の頻度と有効性を操作するためのレバーにすぎません。
基礎:衝突理論
反応を制御するには、まず反応が即座に起こるものではないことを理解する必要があります。それは分子間の物理的な相互作用の結果です。これは衝突理論によって説明されます。
接触の必要性
反応が起こるためには、反応物分子が互いに物理的に衝突しなければなりません。それらが別々の容器に入っている場合、反応は起こりません。反応速度は、これらの衝突の頻度に直接関連しています。
エネルギー要件(活性化エネルギー)
衝突だけでは不十分です。衝突する分子は、活性化エネルギー(Ea)として知られる特定の最小限の運動エネルギーを持っている必要があります。このエネルギーは、新しい結合を形成できるように既存の化学結合を切断するために必要です。
活性化エネルギーを、乗り越えなければならない丘だと考えてください。そっと押すだけ(低エネルギー衝突)では何も起こりません。丘の頂上まで到達させるのに十分な押し込み(十分なエネルギー)を提供する必要があり、その後、反対側に転がり落ちてエネルギーを放出することができます。
配向の要因
最後に、分子は正しい結合が切断され、新しい結合が形成されるように特定の配向で衝突しなければなりません。たとえ十分なエネルギーがあったとしても、間違った角度でのランダムな衝突は反応をもたらしません。

反応速度を制御するための5つのレバー
衝突理論を理解することで、反応を加速または減速させるために操作できる5つの明確なレバーが得られます。それぞれが、衝突頻度、衝突エネルギー、または活性化エネルギー障壁そのものに影響を与えることによって機能します。
1. 反応物の濃度
反応物の濃度を上げるということは、与えられた体積内に多くの分子が詰め込まれていることを意味します。これは衝突の確率を直接的に増加させ、それによって反応速度を増加させます。
2. 温度
温度を上げることは、強力な二重の効果をもたらします。第一に、分子の運動エネルギーが増加し、より速く移動し、より頻繁に衝突するようになります。第二に、そしてより重要なことに、これらの衝突のエネルギーが増加し、より高い割合の衝突が活性化エネルギー障壁を乗り越えるのに十分なエネルギーを持つようになります。
3. 物理的状態と表面積
これは、固体が液体と反応するような異なる相が関与する反応(不均一反応)に最も関連します。固体のブロックは、衝突が発生できる表面積が限られています。同じブロックを細かい粉末に粉砕すると、その表面積が劇的に増加し、反応が発生するためのより多くの分子とより多くの場所が露出します。
4. 触媒
触媒は、プロセスで消費されることなく反応速度を増加させます。これは、より低い活性化エネルギーを持つ代替の反応経路を提供することによってこれを行います。
私たちの類推に戻ると、触媒は丘を貫通するトンネルを掘るようなものです。もはや転がり石を丘の頂上まで押し上げる必要はなく、はるかに少ない労力で反対側に到達できます。これにより、より低い温度でもより多くの分子が首尾よく反応できるようになります。
5. 圧力(気体反応の場合)
気体が関与する反応では、圧力を上げるとガス分子同士がより接近するように強制されます。これは、濃度の増加と実質的に同じであり、より頻繁な衝突とより速い反応速度につながります。
トレードオフの理解
反応速度の操作には代償が伴います。効果的な技術アドバイザーは、各選択肢の実用的および経済的な意味合いを考慮する必要があります。
速度を上げるコスト
温度と圧力を上げるにはエネルギーが必要であり、それは費用がかかります。また、特殊な高圧反応器が必要になる場合があり、これらは建設と維持に費用がかかり、安全性の問題を引き起こします。
触媒のジレンマ
触媒は非常に効果的である可能性がありますが、しばしば高価です(例:白金やパラジウムなどの貴金属の使用)。また、特定の反応に非常に特異的であり、不純物によって不活性化される可能性があり、これは「触媒毒性」として知られています。
望ましくない副反応のリスク
特に過度の熱で反応を強引に進めすぎると、望ましくない結果につながる可能性があります。反応物や生成物が分解し始めたり、増加したエネルギーによって望ましくない副反応が起こり、目的生成物の純度と収率が低下したりする可能性があります。
目標への応用方法
反応を制御するためのあなたの戦略は、何を達成しようとしているかによって完全に異なります。
- 主な焦点が最大速度である場合:最も強力なレバーは、温度を上げることと効果的な触媒を使用することです。これらは両方とも、成功する、エネルギーの高い衝突の数を劇的に増加させるからです。
- 主な焦点が安全性と制御である場合:反応物の濃度を注意深く管理すること(例:一方の反応物を他方にゆっくりと添加する)と、最も低い有効温度を使用することが最良のアプローチです。
- 主な焦点が費用対効果である場合:可能な限り穏やかな条件で最適化します。これには、極端な熱や圧力による高エネルギーコストを避けるために、手頃な価格の触媒を見つけるか、表面積を増やすことが含まれる場合があります。
- 主な焦点が製品純度である場合:分解や副反応を引き起こす可能性のある過度に高い温度を避け、目的の反応に対して触媒が非常に選択的であることを確認してください。
結局のところ、化学反応を制御することは、分子衝突を支配する条件を正確に管理する技術なのです。
要約表:
| 要因 | 反応速度への影響 |
|---|---|
| 濃度 | 濃度の増加は反応物分子間の衝突頻度を増加させる。 |
| 温度 | 分子エネルギーと衝突頻度を上昇させる。より多くの衝突が活性化エネルギーを超える。 |
| 表面積 | 表面積の増大(例:粉末状固体)は、衝突のためのより多くの反応部位を露出させる。 |
| 触媒 | 代替の反応経路を提供することにより、活性化エネルギーを低下させる。 |
| 圧力(気体) | 気体分子の濃度を増加させ、より頻繁な衝突につながる。 |
KINTEKの精密機器で化学反応を最適化しましょう。生産規模の拡大、製品純度の確保、コスト効率の最大化のいずれを目指す場合でも、当社の実験装置と消耗品は、反応条件に対する正確な制御を提供するように設計されています。お客様固有のニーズに合わせて温度、圧力、触媒を管理するための適切なツールを選択できるよう、当社の専門家にご相談ください。お客様の研究所の成功をサポートする方法について、今すぐお問い合わせください!
ビジュアルガイド
関連製品
- 実験用ミニSS高圧オートクレーブ反応器
- ステンレス製高圧オートクレーブ反応器 実験室用圧力反応器
- 高度な科学および産業用途向けのカスタマイズ可能な高圧反応器
- 加熱プレート付き自動加熱油圧プレス機(実験用ホットプレス 25T 30T 50T)
よくある質問
- PE前処理に高圧ステンレス鋼製反応器が必要なのはなぜですか?安全かつ効果的な酸化的酸化を実現
- 酸加水分解に耐食性リアクターシステムを使用する理由。プロセス安全性と高い発酵収率を確保
- 熱分解炉の材質は何ですか?耐久性とコストに見合った適切な鋼材を選びましょう
- 実験室用撹拌型反応器は、どのようにして効果的な結果を保証するのか?触媒的オゾン化における物質移動の最適化
- p-キシレンの触媒的熱水酸化において、高圧マイクロ爆弾バッチ反応器はどのような役割を果たしますか?
- 反応器と反応槽の違いは何ですか?コアコンポーネントと完全なシステムを理解する
- 窒素による高圧反応器のパージの目的は何ですか? 高収率熱液液化を確実にする
- グリセロールのアセタール化に高圧反応器が必要なのはなぜですか?超臨界自己触媒反応を解き放つ



