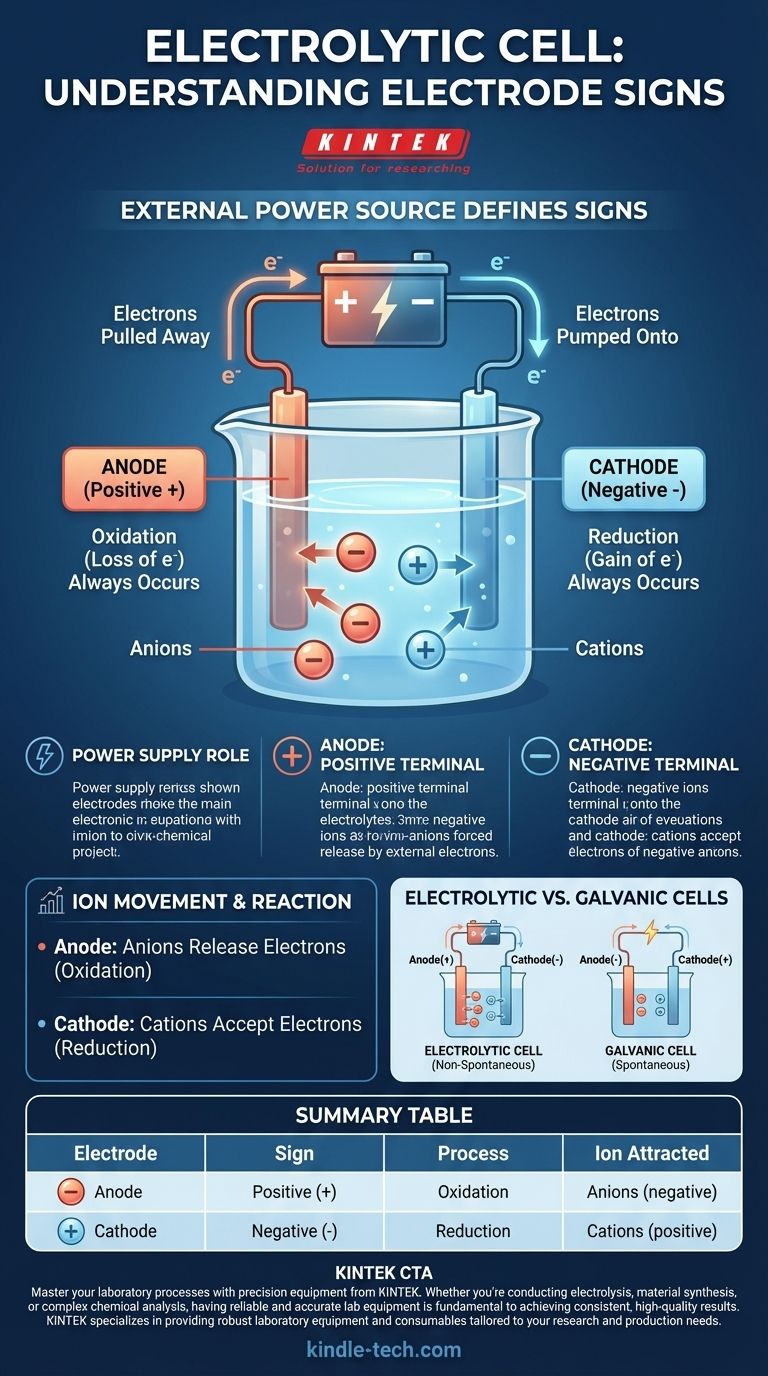
電気分解セルでは、符号の慣習は外部電源によって定義されます。 外部電圧が印加され、自発的には起こらない化学反応を強制的に進行させるため、陽極には正(+)の符号が割り当てられ、陰極には負(-)の符号が割り当てられます。
電気分解セルの理解の鍵は、それが自己完結型のシステムではないことを認識することです。その電極の符号は、接続されている外部電源によって完全に決定され、非自発的な化学変化を起こすように強制されます。
外部電源が符号を定義する理由
電気分解セルは、化学エネルギーを生成するために電気エネルギーを使用します。電気分解として知られるこのプロセスは、反応を開始し維持するために、バッテリーや直流電源などの外部からの力を必要とします。
電源の役割
電源は「電子ポンプ」として機能します。一方の電極から電子を引き抜き、もう一方の電極に送り込むことで、電解質溶液中のイオンに反応を強制する電荷の不均衡を生み出します。
陽極は正極に接続される
外部電源の正極は陽極に接続されます。この端子は陽極から積極的に電子を引き離し、正味の正電荷を残します。
陰極は負極に接続される
逆に、電源の負極は陰極に接続されます。この端子は陰極に積極的に電子を送り込み、電子の過剰と正味の負電荷を与えます。

イオンの移動が反応を生成する方法
電極上の強制された電荷が、電解質に溶解しているイオンを引き付け、それらを移動させて反応するように強制します。酸化と還元の基本的な定義は、どちらのセルタイプでも一定のままです。
陽極:酸化の場(常に)
セルの種類に関係なく、酸化(電子の損失)は常に陽極で起こります。電気分解セルでは、負に帯電したイオン(アニオン)が正の陽極に引き寄せられ、そこで過剰な電子を放出して酸化されます。
陰極:還元の場(常に)
同様に、還元(電子の獲得)は常に陰極で起こります。溶液中の正に帯電したイオン(カチオン)が負の陰極に引き寄せられ、そこで過剰な電子を受け取って還元されます。
重要な区別:電気分解セルとガルバニ電池
標準的なバッテリーのような電気分解セルとガルバニ電池(またはボルタ電池)を比較すると、混乱の主な原因が生じます。それらの符号の慣習は、非常に特定の理由で反対になっています。
自発反応と非自発反応
ガルバニ電池は、電気エネルギーを生成する自発的な化学反応で動作します。ここでは、陽極は電子の自然な発生源であるため負になり、電子が消費される陰極は正になります。
電気分解セルは、電気エネルギーを消費する非自発的な反応で動作します。外部電源は、反応を進行させるために自然な極性を逆転させます。
普遍的な不変量
符号の違いにもかかわらず、両方のセルタイプで中心的なプロセスは同じです。
- 陽極は常に酸化の場です。
- 陰極は常に還元の場です。
符号を記憶する方法
これらの原則を使用して、目的に基づいて慣習を明確に保ちます。
- 主な焦点が端子の特定にある場合: 電気分解セルでは、符号が外部電源と一致することを覚えておいてください。つまり、陽極は正、陰極は負です。
- 主な焦点がイオンの追跡にある場合: 逆電荷の単純な規則に従ってください。負のアニオンは正の陽極に移動し、正のカチオンは負の陰極に移動します。
- 主な焦点がセルタイプの区別にある場合: 「電気分解」を、反応を駆動するために陽極に正電荷を、陰極に負電荷を強制する外部電源と関連付けます。
結局のところ、電気分解セルの符号は、外部電源が化学反応の自然な流れを上回った直接的な結果です。
要約表:
| 電極 | 符号 | プロセス | 引き寄せられるイオン |
|---|---|---|---|
| 陽極 | 正(+) | 酸化 | アニオン(負) |
| 陰極 | 負(-) | 還元 | カチオン(正) |
KINTEKの精密機器で実験室のプロセスを正確に習得しましょう。
電気分解、材料合成、複雑な化学分析を行うかどうかにかかわらず、信頼性が高く正確な実験装置を持っていることは、一貫した高品質の結果を達成するための基本です。KINTEKは、お客様の研究および生産ニーズに合わせて調整された堅牢な実験装置と消耗品の提供を専門としています。
当社のソリューションがお客様のイノベーションを推進し、実験室のワークフローの効率を向上させる方法について、当社の専門家にご相談ください。
ビジュアルガイド
関連製品
よくある質問
- 工業用電解槽の冷却システムが不可欠な理由は何ですか?ピークパフォーマンスのための廃熱管理
- 電気分解セルの本体は何でできていますか?信頼性の高い電気化学のための高ホウケイ酸ガラス
- 特殊な電解採取セルはどのような主な機能を果たしますか?金の回収率と純度を最適化する
- 電気めっきは剥がれますか?めっき仕上げの耐久性と寿命を理解する
- 標準的な3電極電解セルシステムは、AA 6061コーティングをどのように評価しますか?精密腐食分析
- 5ポート水浴式電気分解セルにはどのような定期点検が必要ですか?一貫した電気化学的結果を保証するために
- 薄層分光電気化学セルを使用する前に必要な準備手順は何ですか?信頼性の高い結果を得るためのガイド
- ゼロギャップ電解セルにおいて、PPS製織布セパレーターに要求される特定の機械的・物理的特性は何ですか?



















