電解槽の定義と基本機能
電解槽における電気エネルギーと化学エネルギーの役割を理解する
電気化学セル電気化学セルは、化学反応から電気エネルギーを生成したり、電気エネルギーの導入によって化学反応を促進したりできるデバイスです。
電気化学の定義 電気化学は、電子の移動を引き起こす化学プロセスの研究です。電気エネルギーと化学変化の間の相互作用を扱います。
例: 電気化学セルの研究は電気化学に属します。化学エネルギーを電気エネルギーに変換する細胞を扱います。
電気化学の重要性 電気化学は、電気現象と化学現象の関係を扱います。電気化学プロセスは産業のさまざまな分野で使用されています。これは、いくつかの化学物質の製造にとって最も重要なプロセスです。さまざまな金属の製造は電気化学的方法に基づいています。水素は水の電気分解によって製造されます。電気自動車の開発にも大きな役割を果たしています。
電極と電解質を含む電解槽の構成要素の説明
電解セルは 3 つの必須コンポーネントで構成されています。

アノードは、外部回路に電子を放出し、電気化学反応中に酸化する負極または還元電極です。
カソードは、外部回路から電子を取得し、電気化学反応中に還元される正極または酸化電極です。
電解質は、電池のカソードとアノード間のイオン輸送機構を提供する媒体です。電解質は、イオン伝導に必要な塩、酸、またはアルカリが溶解した水やその他の溶媒などの液体であると考えられることがよくあります。ただし、従来の (AA/AAA/D) 電池を含む多くの電池には、室温でイオン伝導体として機能する固体電解質が含まれていることに注意してください。
正極、負極、電解質の選択における考慮事項
アノード、カソード、および電解質材料の望ましい特性を以下に示します。
電極とイオン間の電荷移動の仕組みを解説
電解槽、電気エネルギーを化学エネルギーに、またはその逆に変換する装置。このようなセルは通常、互いに離れて配置され、電解質(通常は溶解または融合したイオン化合物)と接触する 2 つの金属または電子導体(電極)で構成されます。電極を直流電源に接続すると、電極の一方が負に帯電し、もう一方が正に帯電します。電解質中の正イオンは負極 (カソード) に移動し、そこで 1 つまたは複数の電子と結合し、電荷の一部またはすべてを失い、より低い電荷または中性の原子または分子を持つ新しいイオンになります。同時に、マイナスイオンがプラス電極 (アノード) に移動し、1 つまたは複数の電子をそこに移動させ、新しいイオンまたは中性粒子になります。 2 つのプロセスの全体的な影響は、陰イオンから陽イオンへの電子の移動、つまり化学反応です (酸化還元反応を参照)。一例は、塩化ナトリウム (食塩) の電気分解で、ナトリウム金属と塩素ガスを生成します。反応を進行させるために必要なエネルギーは電流によって供給されます。電気分解の他の一般的な用途には、金属の精製またはメッキのための電着、および苛性ソーダの製造が含まれます。
電解槽とは何ですか?電解槽は、電気エネルギーを使用して非自発的な酸化還元反応を促進する電気化学装置として定義できます。電解セルは、特定の化合物の電気分解に使用できる電気化学セルです。たとえば、水を(電解槽を使用して)電気分解して、ガス状の酸素とガス状の水素を生成することができます。これは、(反応環境への)電子の流れを利用して、非自発的酸化還元反応の活性化エネルギー障壁を克服することによって行われます。


電解槽の 3 つの主要な構成要素は次のとおりです。 カソード (電解セルでは負に帯電します) アノード (電解セルでは正に帯電します) 電解質 電解質は、カソードとアノードの間で電子を交換するための媒体を提供します。電解槽で一般的に使用される電解質には、水 (溶解イオンを含む) と溶融塩化ナトリウムが含まれます。
電解セル 電解セルを定義するには、まず電気分解について理解する必要があります。電気分解は、イオンを含む液体に電流を流し、内部の化合物を分解する方法です。これは、金属を金属元素から隔離し、他の化学物質 (水など) や金属を電気メッキし、バッテリーを充電するために使用されます。電解プロセスを維持するには、完全な回路が不可欠です。セルから継続的に電力を取り出すことができる必要があります。
電解槽の陰極と陽極は電源に接続されています。これら 2 つの安定した電極と流体電解質溶液は、すべての電解槽にあります。電解質溶液は、溶解したイオンが溶液中で自由に移動できるため、電気を伝導します。
電解セルとそのコンポーネント 電解セルは、バッテリー、電極、電解液という 3 つの主要コンポーネントで構成されます。バッテリー バッテリーは電源として機能します。電気エネルギーを供給して化学変化、つまりイオン性化合物の分解を引き起こします。電極 電極は、ワイヤと電解質の間の電気回路を閉じる、または完成させる電気接点です。電極としては、炭素棒(グラファイト)や金属板などが挙げられる。バッテリーのプラス端子に接続されている左側の電極 (上の図を参照) が、プラス極またはアノードです。バッテリーのマイナス端子に接続されている右側の電極は、マイナス極またはカソードです。電解質 電解質は、溶融または水溶液中に可動イオンを含み、電気を伝導する物質です。電解質の例には、溶融塩化ナトリウム、硫酸銅(II)溶液、および希塩酸などの酸が含まれます。非電解質の例には、電気を伝導する可動イオンを含まない液体または溶液である砂糖溶液、エタノール、(溶融)硫黄が含まれます。

アプリケーション 電解セルは、電気分解と呼ばれるプロセスで化合物を分解するためによく使用されます。エレクトロは電気を意味し、ギリシャ語の溶解は分解を意味します。電気分解の重要な例としては、水を水素と酸素に分解し、ボーキサイトをアルミニウムやその他の化学物質に分解することが挙げられます。電気メッキ (銅、銀、ニッケル、クロムなど) は、電解槽を使用して行われます。電気分解は、直流 (DC) を使用する技術です。
商業的には、電解槽はいくつかの非鉄金属の電解精製および電解採取に使用されています。高純度のアルミニウム、銅、亜鉛、鉛のほとんどは、電解槽で工業的に生産されます。
電解槽 電解槽の 3 つの構成要素は、電解質と 2 つの電極です。
電解質 電解質は、水などの極性溶媒に溶解すると導電性溶液を与える物質です。これは、電解質が極性溶媒に溶解すると、陽イオンと陰イオンに分解され、溶液全体に均一に分布するためです。溶液中の電位下にあるこれらのカチオンとアニオンは、それぞれ電子が豊富な状態と電子が不足している状態で電極に移動します。この陽イオンと陰イオンの互いに反対方向への移動により電流が発生し、電解槽が形成されます。
塩、酸、塩基は電解質を形成しますが、高温低圧の塩化水素など、特定の条件下ではいくつかのガスも電解質のように振る舞うことがあります。
電解槽内の化学反応
電解槽における酸化還元反応の説明
電気化学セルでは、酸化還元 (レドックス) 反応が起こります。電気化学セルには 2 つのタイプがあります。1 つは自発的反応が起こるガルバニック (ボルタ) セル、もう 1 つは非自発的反応が起こる電解セルです。
どちらのタイプの電池にも電極があり、そこで酸化反応と還元反応が起こります。酸化は陽極と呼ばれる電極で起こり、還元は陰極と呼ばれる電極で起こります。
電解槽では、アノードがプラス、カソードがマイナスになります。これは、陽極が溶液から陰イオンを引き付けるためです。一方、ガルバニ電池では、アノードでの自然酸化が電池の電子または負電荷の源であるため、アノードは負に帯電します。ガルバニ電池の陰極は、そのプラス端子です。
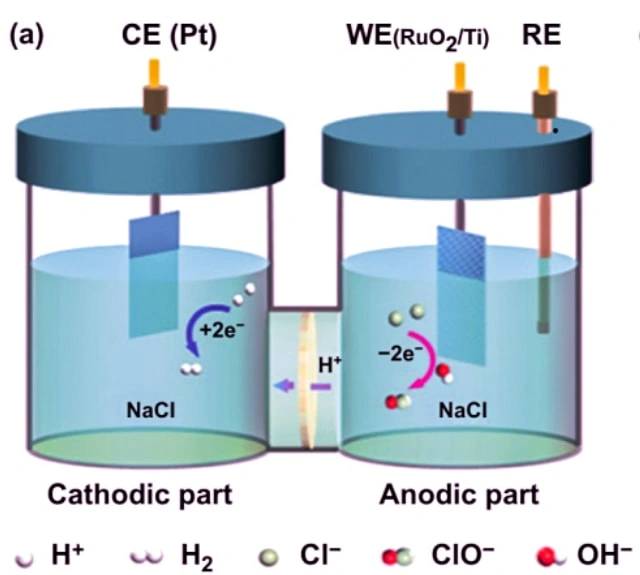
塩化ナトリウムの電気分解例
電解槽の一例は、塩化ナトリウムの電気分解です。塩化ナトリウムを水に溶かして電気分解すると、次のような反応が起こります。
カソード: 2 H2O + 2 e- -> 2 OH- + H2
アノード: 2 Cl- -> Cl2 + 2 e-
全体の反応: 2 NaCl + 2 H2O -> 2 Na + Cl2 + H2 + 2 OH-
この電解槽では、2 つの不活性電極が溶融塩化ナトリウムに浸されています。電流が回路を通過すると、陰極には電子が豊富になり、負の電荷が発生します。正に帯電したナトリウムイオンは陰極に引き寄せられ、その結果ナトリウム金属が形成されます。同時に、塩素原子が正に帯電したアノードに引き寄せられ、塩素ガスが生成されます。全体的な結果として、金属ナトリウム、塩素ガス、および水酸化ナトリウム水溶液が生成されます。
電解槽の応用例
電解槽にはさまざまな用途があります。
- 水から酸素ガスと水素ガスを製造します。
- ボーキサイトからのアルミニウムの抽出。
- 電気メッキ。別の金属の表面に特定の金属の薄い保護層を形成します。
- 非鉄金属の電解精錬。
- 電解回復プロセス。
- 高純度銅、高純度亜鉛、高純度アルミニウムの工業生産は、ほとんどの場合、電解槽を介して行われます。
![電解槽の応用(高純度亜鉛、高純度アルミニウム、高純度銅)]()
電解槽の応用(高純度亜鉛、高純度アルミニウム、高純度銅)
電解槽はさまざまな産業やプロセスで重要な役割を果たし、重要な化学物質や材料の生産を可能にします。
電気分解の応用
金属の精製やメッキのための電着における電気分解の使用
電気分解は、金属を精製またはメッキするための電着プロセスで広く使用されています。これに関連した電気分解の実際的な応用例の 1 つは、電気洗浄です。電解洗浄では、亜鉛やアルミニウムなどの被洗浄物を陰極とし、電解液に大電流を流します。陰極では苛性ソーダと水素が生成され、物品の表面からグリースや不純物を効果的に除去します。このプロセスは金属の精製やメッキに使用でき、きれいで光沢のある外観を提供し、腐食から保護し、摩耗した材料を交換します。
電気分解による苛性ソーダの製造
電気分解のもう 1 つの重要な用途は、苛性ソーダ (NaOH) や塩素ガスなどの化学物質の大規模な生産です。このプロセスでは、電気分解を使用して塩化ナトリウム (NaCl) をその構成要素であるナトリウム (Na) と塩素 (Cl2) に分解します。カソードでの反応にはナトリウム イオン (Na+) の金属ナトリウム (Na) への還元が含まれますが、アノードでは塩化物イオン (Cl-) が酸化されて塩素ガス (Cl2) が形成されます。全体的な細胞反応は 2NaCl → 2Na + Cl2 です。この電解プロセスにより、さまざまな産業用途に使用される大量の苛性ソーダと塩素ガスが生成されます。
金属抽出における電気分解
電気分解は、鉱石から金属を抽出する際に重要な役割を果たします。電気分解を使用した金属抽出には主に 2 つの方法があります。最初の方法では、鉱石を強酸で処理して塩を取得し、得られた塩溶液を電気分解して金属を遊離します。 2 番目の方法では、鉱石は溶融状態にあり、炉内で直接電気分解されます。
電気分解を使用した金属抽出の一例は、亜鉛の抽出です。亜鉛鉱石を硫酸で処理して硫酸亜鉛溶液を形成し、その後電気分解します。電解槽にはアルミニウムの陰極と鉛の陽極が使用されています。亜鉛はカソードに堆積し、硫酸はアノードで再生されます。この電解プロセスにより、高純度の亜鉛の抽出が可能になります。
同様に、電気分解はボーキサイトからのアルミニウムの抽出にも使用されます。アルミニウム鉱石であるボーキサイトを溶融氷晶石に溶解し、電気分解します。アルミニウムイオンはカソードで還元されて金属アルミニウムを形成し、アノードでは酸素ガスが生成されます。このプロセスにより、高純度のアルミニウムの製造が可能になります。

全体として、電気分解は、金属の抽出、精製、メッキのほか、苛性ソーダなどの化学薬品の製造など、さまざまな産業で実用化されています。電気分解の力を活用することで、企業は高品質の結果を達成し、それぞれの業界の要求を満たすことができます。
化学エネルギーから電気への変換
エネルギーを発生する物質の反応におけるエネルギー発生の説明
電気化学セルでは、電気分解と呼ばれるプロセスを通じて化学エネルギーが電気エネルギーに変換されます。電気分解は、電気化学セル内で起こる酸化還元反応であり、化学物質が電極で分解されます。電気分解の生成物は、セルで使用される電極と電解質の種類によって異なります。このプロセスは、電気化学におけるさまざまな応用の基礎となります。
電気化学の分野には、自発的な化学反応中に放出されるエネルギーから電気を生成することや、電気エネルギーを使用して非自発的な化学変化を引き起こすことが含まれます。種間の電子の移動を伴う酸化還元反応は、これらのプロセスの中核です。多くの化学反応や生物学的反応は酸化還元反応であり、家庭用、輸送用、工業用のエネルギーを得る上で重要な役割を果たします。
これらの反応で生成されるエネルギーは、動物の食物消化のための燃料の燃焼、工業プロセス、光合成、鉱石からの金属の抽出、重要な化学物質の製造、電池や燃料電池の動作など、幅広い用途で使用されます。
鉛蓄電池の例
化学エネルギーを電気に変換する一例は、鉛酸蓄電池です。このタイプのバッテリーは、車両の電源として一般的に使用されます。相互に接続された複数の電気化学セルで構成されます。

鉛蓄電池は、電解電池とガルバニ電池の両方として動作します。放電時には、ガルバニ電池として機能し、化学エネルギーを電気エネルギーに変換します。放電プロセス中に、二酸化鉛、金属鉛、硫酸が反応して硫酸鉛と水が形成されます。鉛の硫酸鉛への酸化は一方の電極で起こり、二酸化鉛から硫酸鉛への還元はもう一方の電極で起こります。電荷は水素イオンの移動によって電解質を通って輸送されます。
この酸化プロセスと還元プロセスの分離により、2 つの電極を接続する外部回路に電気が流れる駆動力、つまり電圧が生成されます。他にも多くの化学の組み合わせがセルやバッテリーに利用されており、それぞれが独自の反応と特性を持っています。
燃料電池
燃料電池は、燃料の化学エネルギーを電気に変換する別のタイプの電気化学電池です。これらの電池は、水素燃料と酸化剤、通常は酸素との間の電気化学反応を通じて動作します。すでに充填されている化学薬品からエネルギーを生成するバッテリーとは異なり、燃料電池は電気を生成するために継続的な酸素の流れと燃料の供給を必要とします。
燃料電池は、宇宙カプセルや人工衛星用の電力を生成するために NASA によって商業的に使用されています。カルノーサイクル損失を回避できるため、熱力学的効率の点で利点があります。しかし、現在の燃料電池技術は、全体的な効率と信頼性の点で依然として課題に直面しています。 1 つの制限は、炭化水素を直接使用できないことであり、一般的な燃料を水素に変換する処理ステップが必要です。さらに、酸素還元の触媒作用は複雑なプロセスです。

要約すると、化学エネルギーから電気への変換は電気化学の基本的なプロセスです。これは、鉛酸蓄電池や燃料電池などの電気化学電池における酸化還元反応によって発生します。これらの技術は、車両の動力から宇宙探査用の発電まで、さまざまな用途に利用できます。
発電用の代替セル
太陽電池と半導体の役割、光吸収について理解する
- アモルファス シリコン (A-Si) は、結晶シリコンの約 40 倍の光吸収率を持つ主要な薄膜 PV 材料です。
- テルル化カドミウム (CdTe) も、高い光吸収率を備えた薄膜材料です。わずか1mmの薄膜で太陽光スペクトルの90%を吸収できます。
- 二セレン化銅インジウム (CIGS) は、PV で高い効率を達成した半導体材料であり、商用モジュールでは 14% 以上の効率に達しています。

燃料電池とその酸化剤・還元剤の使い方について解説
- 燃料電池は、水素燃料を酸素または他の酸化剤と反応させて化学エネルギーを電気に変換する電気化学電池です。
- 化学反応を維持するために燃料と酸素の継続的な供給源が必要なため、バッテリーとは異なります。
- 燃料電池は、燃料と酸素が供給される限り継続的に電気を生成することができます。
- これらは、商業、工業、住宅の建物、遠隔地などのさまざまな用途で主電源およびバックアップ電源として使用されます。
- 燃料電池は、フォークリフト、自動車、バス、ボート、オートバイ、潜水艦などの燃料電池車両に電力を供給するためにも使用されます。
- 世界の燃料電池市場は、2030 年までに 19.9% 増加すると予想されています。
その他の発電用セル
- 太陽電池は、半導体による光の吸収によって電気を生成します。
- 燃料電池は、燃料からの化学エネルギーを使用して電気を生成します。
- 充電式電池は、充電することで何度でも使用できます。
- 非充電式セルは再利用できないため、廃棄する必要があります。
- 鉛酸/鉛蓄電池は、車両の電源として使用される二次電池です。
- 薄膜太陽電池、薄膜トランジスタ、薄膜電池などの薄膜セルは、従来のセルと比べて効率が向上し、充電が速くなり、寿命が長くなります。
発電用の代替電池の分野は常に進化しています。研究者は薄膜材料の効率と特性を改善し続けている一方、業界の専門家はコスト削減と生産規模の拡大に取り組んでいます。
この製品に興味がある場合は、当社の Web サイトを参照してください: https://kindle-tech.com/products/h-type-electrolytic-cell-h-type-triple 。当社は常に品質第一の原則を主張します。生産プロセスでは、高品質の素材と高度な生産技術を使用して、製品の安定性と耐久性を確保するために、プロセスのすべての段階を厳密に管理します。パフォーマンスが最高の基準を満たしていることを確認します。私たちは、お客様に優れた品質を提供することによってのみ、お客様の信頼と長期的な協力を得ることができると信じています。

















