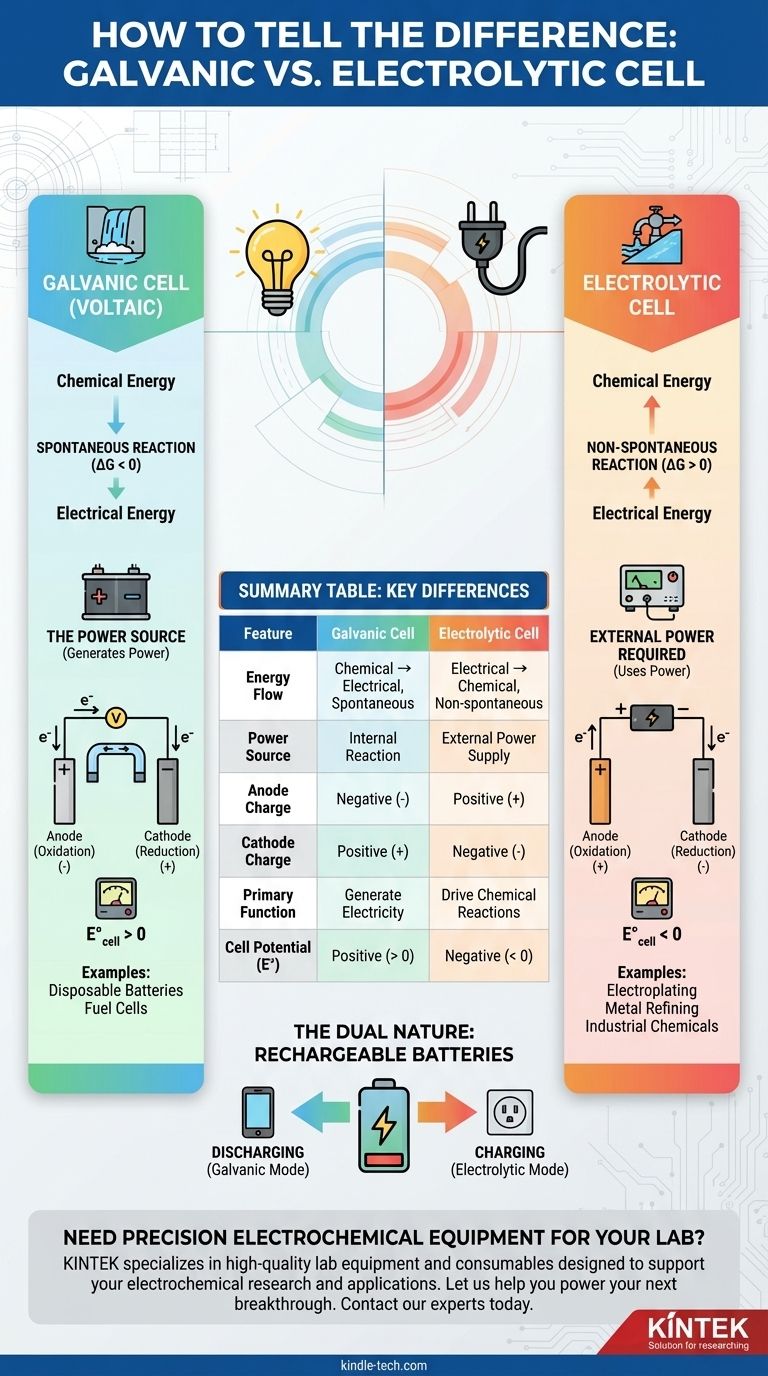
ガルバニ電池と電解槽の根本的な違いは、エネルギーの流れにあります。ガルバニ電池(ボルタ電池とも呼ばれる)は、自発的な化学反応を利用して電気エネルギーを生成します。対照的に、電解槽は外部の電気エネルギーを利用して、非自発的な化学反応を強制的に起こさせます。
このように考えてみてください:ガルバニ電池は、自然に下り坂を流れる滝が発電するようなものです。電解槽は、外部の電力を使って水を重力に逆らって上り坂に押し上げるポンプのようなものです。
核心原理:自発性とエネルギー変換
あらゆる電気化学電池の挙動は、その内部反応が自力で進行するか、外部からの介入を必要とするかによって決まります。
ガルバニ電池:化学エネルギーの放出
ガルバニ電池は、自発的な酸化還元反応によって定義されます。これは、反応が自力で起こりたがり、その過程でエネルギーを放出することを意味します。
このプロセスは、蓄えられた化学エネルギーを直接電気エネルギーに変換します。電池自体が電源となります。
熱力学的には、これは負のギブズ自由エネルギー(ΔG < 0)と正の電池電位(E°_cell > 0)に対応します。
電解槽:電気エネルギーの入力
電解槽は、非自発的な反応を伴います。外部からの働きかけがなければ、この反応は進行しません。
反応を進行させるためには、バッテリーやDC電源のような外部電源が必要です。このプロセスは、電気エネルギーを化学エネルギーに変換します。
これは、正のギブズ自由エネルギー(ΔG > 0)と負の電池電位(E°_cell < 0)に対応します。反応を強制するには、外部電圧がこの負の電位よりも大きくなければなりません。

各電池の識別方法:主要な指標
エネルギーの流れの方向だけでなく、電極の極性や全体の回路を観察することで、2つの電池を区別できます。
電源
これが最も分かりやすい指標です。電気化学電池がデバイスに電力を供給するバッテリーである場合、それはガルバニ電池です。
電池が外部バッテリーまたは電源に接続されている場合、それは電解槽です。外部電源がプロセスを駆動するためのエネルギーを提供します。
電極の極性(よく混同される点)
アノードとカソードの定義は、両方の種類の電池で一定です。
- アノード: 酸化が起こる電極。
- カソード: 還元が起こる電極。
ただし、その正/負の電荷(極性)は反転します。
ガルバニ電池では、アノードでの自発的な反応が電子を放出し、アノードは負極(-)となります。電子を消費するカソードは正極(+)となります。
電解槽では、外部電源が極性を決定します。外部電源はアノードから電子を引き離し、アノードを正極(+)とし、カソードに電子を押し込み、カソードを負極(-)とします。
一般的な用途と落とし穴
電池の目的は、最も実用的な識別子です。一方は電力を生成し、もう一方は電力を使って物質を生成したり変化させたりします。
ガルバニ電池の目的
ガルバニ電池の唯一の機能は、電力源として機能することです。
一般的な例としては、使い捨て電池(単3形、単4形)、燃料電池、そして車のエンジンを始動させる際のカーバッテリーの主要機能などがあります。
電解槽の目的
電解槽の目的は、通常は起こらない有用な化学変換を促進することです。
典型的な用途には、金属表面への薄い金属層の電気めっき、銅やアルミニウムなどの金属の精錬、塩素ガスなどの工業用化学物質の製造などがあります。
充電式バッテリーの二面性
充電式バッテリーは、両方の種類の電池が1つのデバイスに収められた完璧な例です。
- 放電中(携帯電話に電力を供給しているとき): ガルバニ電池として機能し、自発的な反応によって電気が生成されます。
- 充電中(壁のコンセントに接続されているとき): 電解槽として機能し、外部エネルギーが非自発的な逆反応を強制してエネルギーを蓄えます。
目的に合った正しい区別をする
どの電池を扱っているかを素早く判断するには、エネルギーの流れとシステムの全体的な目的に焦点を当ててください。
- 主な焦点が発電である場合: 自発的な反応がエネルギーを放出するガルバニ電池を扱っています。
- 主な焦点が物質の生成または反応の逆転である場合: 非自発的なプロセスを促進するために外部電源を必要とする電解槽を使用しています。
- 電極の符号を分析している場合: ガルバニ電池ではアノードが負極であり、電解槽では正極であることに注意してください。これは、エネルギー源が内部か外部かによるものです。
最終的に、エネルギーが生成物であるか要件であるかを理解することが、これら2つの基本的な電気化学電池を区別するための鍵となります。
要約表:
| 特徴 | ガルバニ電池 | 電解槽 |
|---|---|---|
| エネルギーの流れ | 化学 → 電気(自発的) | 電気 → 化学(非自発的) |
| 電源 | 内部反応 | 外部電源 |
| アノードの電荷 | 負極(-) | 正極(+) |
| カソードの電荷 | 正極(+) | 負極(-) |
| 主な機能 | 発電 | 化学反応の促進(例:電気めっき) |
| 電池電位(E°) | 正(> 0) | 負(< 0) |
研究室に精密な電気化学機器が必要ですか?
ガルバニ電池と電解槽のニュアンスを理解することは、高度な実験作業にとって非常に重要です。新しいバッテリー技術の開発、電気めっきの実施、材料分析のいずれを行う場合でも、適切な機器が不可欠です。
KINTEKは、お客様の電気化学研究とアプリケーションをサポートするために設計された高品質の実験機器と消耗品を専門としています。当社は、正確な結果を保証し、研究室の効率を高める信頼性の高いソリューションを提供します。
次のブレークスルーを推進するお手伝いをさせてください。 今すぐ当社の専門家にお問い合わせください。お客様の特定の実験室のニーズについて話し合い、当社の製品がお客様の成功をどのように推進できるかを発見してください。
ビジュアルガイド
関連製品
- 5ポート電解セル
- コーティング評価用電解セル
- 電解電気化学セル ガス拡散液体フロー反応セル
- バッテリーラボ機器 バッテリー容量・総合テスター
- バッテリーラボ用途向け親水性カーボンペーパー TGPH060
よくある質問
- 5ポート水浴電気分解セルの使用後の手順は何ですか?安全性と長寿命を確保してください
- インサイチュラマンスペクトル電気化学セルの材質と主な特徴は何ですか?分光研究を最適化しましょう
- H型電解セルの全体構造とは?デュアルチャンバー電気化学設計の理解
- 電気化学反応システムはどのようにチタン表面を最適化しますか?生体活性歯科インプラントのエンジニアリング
- スーパーシール型電気化学セルを使用する前に必要な手順は何ですか?安全性とデータ保全性を確保してください
- 工業用電解槽の冷却システムが不可欠な理由は何ですか?ピークパフォーマンスのための廃熱管理
- TiO2上のGQDsに対する電着の利点は何ですか?研究における接着性と精度を高める
- 電解槽の電極はどのように維持すべきですか?性能と寿命を最大化するためのガイド




